
科目: 来源: 题型:选择题
| A. | 按系统命名法,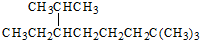 的名称为2,2,7-三甲基-6-乙基辛烷 的名称为2,2,7-三甲基-6-乙基辛烷 | |
| B. | 青蒿素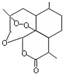 是抗恶性疟疾特效药,其分子式为C15H20O5 是抗恶性疟疾特效药,其分子式为C15H20O5 | |
| C. | 1mol达菲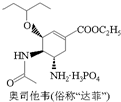 最多能与4molNaOH反应 最多能与4molNaOH反应 | |
| D. | CH3CH=CH-CH=CH2与溴的四氯化碳溶液发生加成反应最多可生成3种产物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫酸亚铁铵晶体要用冷水洗涤,而阿斯匹林过滤后则须用无水酒精洗涤 | |
| B. | 食醋总酸含量的测定实验中,若滴定终点没有控制好,即NaOH溶液滴加过量,则必须重做实验 | |
| C. | 火柴头中的氯元素检验的实验中,将火柴头(未燃烧)浸于水中,片刻后取少量溶液,加AgNO3溶液、稀硝酸,若出现白色沉淀,证明有氯元素 | |
| D. | 毒物误入口内,可将5~10mL稀硫酸铜溶液加入一杯温水中内服,人工促使呕吐出毒物后送医院 |
查看答案和解析>>
科目: 来源: 题型:解答题
| CH4 | SiH4 | NH3 | PH3 | |
| 沸点(K) | 101.7 | 161.2 | 239.7 | 185.4 |
| 分解温度(K) | 873 | 773 | 1073 | 713.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
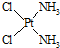 )中的Pt的化合价为+2.
)中的Pt的化合价为+2.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径(10-10 m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 | |
| 化合价 | 最高价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 负价 | -2 | -3 | -1 | -3 | |||||
| A. | 电负性的大小:⑥<②<④<⑤ | |
| B. | 单质熔点的高低:②<⑥ | |
| C. | 第一电离能的大小:③<⑧<⑦<① | |
| D. | 最高价氧化物对应水化物的酸性强弱:④<⑤<⑦ |
查看答案和解析>>
科目: 来源: 题型:多选题
 在常温下A、B、C、D、E是5种常见的气体,F是固体,它们之间存在如下的转化关系,转化关系中涉及的三步反应均是化合反应.已知D分子是含有18个电子的异核双原子分子,E是4核10电子分子.下列说法中不正确的是( )
在常温下A、B、C、D、E是5种常见的气体,F是固体,它们之间存在如下的转化关系,转化关系中涉及的三步反应均是化合反应.已知D分子是含有18个电子的异核双原子分子,E是4核10电子分子.下列说法中不正确的是( )| A. | 固体F中含有配位键 | B. | D和E分子间均可形成氢键 | ||
| C. | A、B、C三种分子均属于非极性分子 | D. | E分子中中心原子的杂化类型为sp2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O和H2O2两种分子中O原子的杂化类型相同 | |
| B. | NH3和NH4+两种微粒的空间结构相同 | |
| C. | SO42-和ClO4-两种微粒的键角相等 | |
| D. | SO2和O3两种分子是等电子体 |
查看答案和解析>>
科目: 来源: 题型:选择题
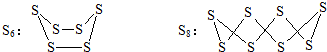
| A. | 硫单质S原子间都以σ键结合 | |
| B. | S6、S8分子中所有S原子都发生了sp3杂化 | |
| C. | S6和S8互为同位素 | |
| D. | 熔点的高低:S8>S6>S4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com