
科目: 来源: 题型:填空题
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | ||
| CO | H2O | H2 | CO | ||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 |
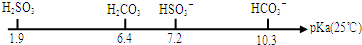
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 向溶液中加水稀释至10 L | B. | 加入一定量的NaOH固体 | ||
| C. | 加入一定量pH=8的NaOH溶液 | D. | 加入一定浓度的盐酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
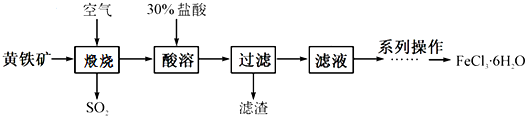
查看答案和解析>>
科目: 来源: 题型:解答题

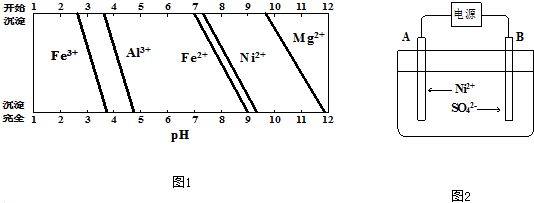
查看答案和解析>>
科目: 来源: 题型:解答题
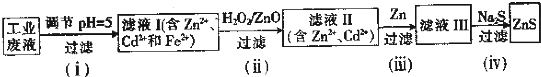
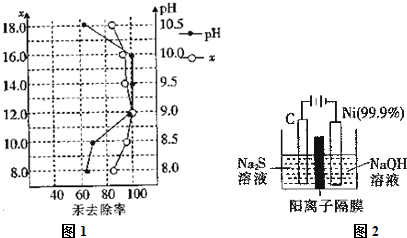
查看答案和解析>>
科目: 来源: 题型:解答题
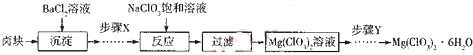
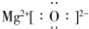 .
.查看答案和解析>>
科目: 来源: 题型:解答题
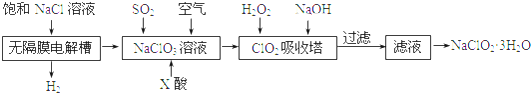
查看答案和解析>>
科目: 来源: 题型:选择题
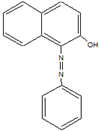 2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )
2005年2月18日,英国食品标准局就辣椒粉等一些食品检出苏丹红色素向消费者发出警告,引起媒体和消费者的广泛关注.中国卫生部于4月6日就公众关心的苏丹红对人体危害问题发表公告及《苏丹红危险性评估报告》指出,偶然摄入含有少量苏丹红的食品对人体造成危害的可能性较小,但如果长期大剂量摄入会增加人体致癌的危险.如图是苏丹红一号的结构简式,下列有关苏丹红一号的说法正确的是( )| A. | 它属于芳香烃 | B. | 它的分子式为C16H13ON2 | ||
| C. | 它能发生取代反应和加成反应 | D. | 它与苯互为同系物 |
查看答案和解析>>
科目: 来源: 题型:解答题
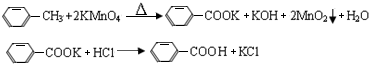
| 名称 | 相对分子质量 | 性状 | 熔点 | 沸点 | 密度 | 溶解度 | ||
| 水 | 乙醇 | 乙醚 | ||||||
| 甲苯 | 92 | 无色液体易燃易挥发 | -95 | 110.6 | 0.8669 | 不溶 | ∞ | ∞ |
| 苯甲酸 | 122 | 白色片状或针状晶体 | 122.4 | 248 | 1.2659 | 微溶 | 易溶 | 易溶 |
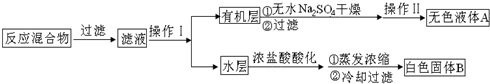
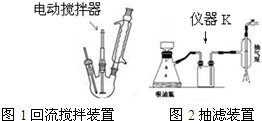
 .操作Ⅱ为蒸馏.
.操作Ⅱ为蒸馏.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com