
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
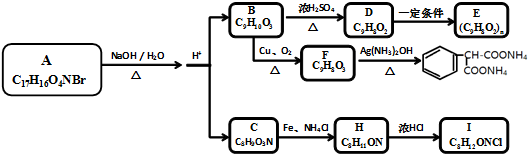
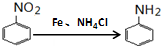
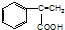 ,C→H的反应类型是还原反应.
,C→H的反应类型是还原反应.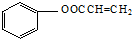 ,
,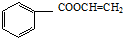 .
.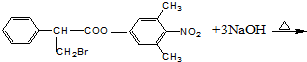
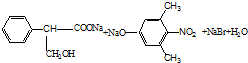 .
.查看答案和解析>>
科目: 来源: 题型:解答题
| 方法一 | CO(g)+2H2(g)?CH3OH(g) |
| 方法二 | CO2(g)+3H2(g)?CH3OH(g)+H2O(g) |

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,向0.1mol•L -1的醋酸溶液中加入醋酸钠晶体,若混合液的pH=7,则该溶液中c(Na+)>c(CH3COO-) | |||||||||||
| B. | 根据下表中有关共价键的键能:
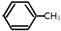 (g)+3H2(g)→ (g)+3H2(g)→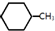 (g)的△H=-348kJ•mol-1 (g)的△H=-348kJ•mol-1 | |||||||||||
| C. | 一定量的复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,在某一时刻,反应的离子方程式可能是2Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Fe(OH)3↓ | |||||||||||
| D. | 已知:25°C,Ksp(BaSO4)=1×10-10,向该温度下的饱和BaSO4溶液中加入一定量的硫酸钠或氯化钡固体后使Ksp(BaSO4)增大 |
查看答案和解析>>
科目: 来源: 题型:选择题
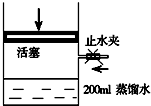
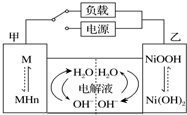 发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )
发展混合动力车是实施节能减排的重要措施之一.汽车上坡或加速时,电动机提供推动力,降低了汽油的消耗;在刹车和下坡时电动机处于充电状态以节省能耗.混合动力车的电动机目前一般使用的是镍氢电池,镍氢电池采用镍的化合物为正极,储氢金属(以M表示)为负极,电解液为碱液(主要为KOH)(见图).镍氢电池充放电原理总反应式为:H2+2NiOOH$?_{充电}^{放电}$2Ni(OH)2.下列有关混合动力车的判断正确的是( )| A. | 在刹车和下坡时,甲电极的电极反应式为:H2+2OH--2e-═2H2O | |
| B. | 在上坡或加速时,甲电极周围溶液的pH将减小 | |
| C. | 在上坡或加速时,溶液中的K+向甲电极迁移 | |
| D. | 在刹车和下坡时,乙电极增重 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
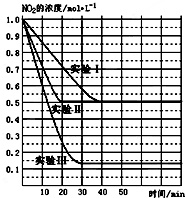 (1)某条件下,在2L密闭容器中充入NO2发生如下反应:
(1)某条件下,在2L密闭容器中充入NO2发生如下反应:| 弱电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数 | Ka1=4.30×10-7 Ka2=5.61×10-11 | 1.77×10-5 |
查看答案和解析>>
科目: 来源: 题型:解答题
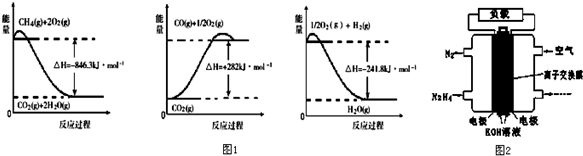
查看答案和解析>>
科目: 来源: 题型:解答题
 有A、B、C、D、E五种短周期元素,A、C同周期,B、D同主族,E是五种元素中原子半径最小的元素.A是构成矿物和岩石的主要成分的元素,C、D可生成离子化合物C3D2.A的单质与E的单质在常温下就可发生反应,生成化合物F.据此回答下列问题:
有A、B、C、D、E五种短周期元素,A、C同周期,B、D同主族,E是五种元素中原子半径最小的元素.A是构成矿物和岩石的主要成分的元素,C、D可生成离子化合物C3D2.A的单质与E的单质在常温下就可发生反应,生成化合物F.据此回答下列问题: ;A单质及其最高价氧化物均属于原子晶体(填晶体类型)
;A单质及其最高价氧化物均属于原子晶体(填晶体类型)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com