
科目: 来源: 题型:填空题
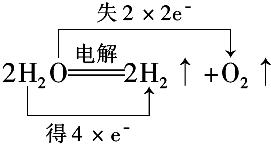 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3?1?1 | B. | 3?1?4 | C. | 1?1?1 | D. | 2?1?1 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
 醋酸是重要的一元酸,在有机和无机反应中都有应用.现有25℃时,pH=2的醋酸.请回答以下问题:
醋酸是重要的一元酸,在有机和无机反应中都有应用.现有25℃时,pH=2的醋酸.请回答以下问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在甲、乙两烧杯的溶液中,共含有Cu2+、K+、H+、Cl-、CO32-、OH-六种离子.已知甲烧杯的溶液含其中3种离子并呈蓝绿色,则乙烧杯的溶液中含有的3种离子是K+、OH-、CO32- | |
| B. | 常温下pH=7的溶液中:Fe3+、Mg2+、SO42-、Cl-能大量共存 | |
| C. | 在含有HCO3-、SO32-、S2-、CH3COO-四种阴离子的溶液中加入足量的BaO2固体后,S2-浓度变化最小 | |
| D. | 常温下水电离出c(H+)•c(OH-)=10-20的溶液中:Na+、ClO-、S2-、NH4+能大量共存 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锂在过量氧气中燃烧,主要产物是Li2O而不是Li2O2 | |
| B. | Li2CO3受热很难分解 | |
| C. | 在相同温度下,溶解度Li2CO3小于LiHCO3 | |
| D. | 少量的锂保存在固体石蜡中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在100mL0.5mol/LCH3COOH溶液中CH3COOH分子数等于0.05NA | |
| B. | 在标况下,22.4L辛烷含共价键数为25NA | |
| C. | 已知PbI2的KSP=7.0×10-9,将1.0×10-2mol/L的KI与Pb(NO3)2溶液等体积混合,则生成PbI2沉淀所需Pb(NO3)2溶液的最小浓度为5.6×10-4 mol/L | |
| D. | 25℃时,1LpH=13的Ba(OH)2溶液中含有OH-数目为0.2NA |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | n(Ca2+)减小 | B. | c(Ca2+)减小 | C. | n(OH-)增大 | D. | c(OH-)减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com