
科目: 来源: 题型:选择题
| 选项 | 反应物质 | 反应结果 | 影响因素 |
| A | Na O2 | Na2O Na2O2 | 反应温度 |
| B | Cu HNO3 | NO NO2 | 铜的还原性 |
| C | 澄清石灰水 CO2 | 浑浊或者澄清 | CO2通入量 |
| D | Na2CO3溶液 盐酸 | 立即产生气体或最后产生气体 | 试剂加入顺序 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 该溶液中,K+、Mg2+、Cl2、SO42-可以大量共存 | |
| B. | 已知电离平衡常数K(H2SO3)>K(H2CO3)>K(HSO3-),则该溶液中NH4+、HCO3-、Na+、Cl-不可以大量共存 | |
| C. | 和足量Ca(OH)2溶液反应的离子方程式:Ca2++OH-+HSO3-=CaSO3↓+H2O | |
| D. | 与稀HNO3反应的离子方程式:HSO3-+H+=SO2↑+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 (1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:
(1)某学生设计的用该浓盐酸与二氧化锰反应制取并收集干燥纯净的氯气的装置如图:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1.0mol/L | C. | 1.5mol/L | D. | 2.0mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 液氯贮存在干燥的钢瓶里 | |
| B. | 少量的锂、钠、钾均保存在煤油中 | |
| C. | 浓溴水保存在带橡皮塞的棕色细口瓶中 | |
| D. | 用排水法收集满一瓶氢气,用玻璃片盖住瓶口,瓶口朝上放置 |
查看答案和解析>>
科目: 来源: 题型:解答题
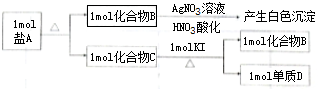
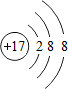 ;
;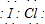 ;化合物C中显正价的是碘元素;
;化合物C中显正价的是碘元素;查看答案和解析>>
科目: 来源: 题型:解答题
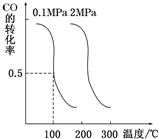 随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.
随着能源与环境问题越来越被人们关注,碳一化学成为研究的热点.“碳一化学”即以单质碳及CO、CO2、CH4、CH3OH等含一个碳原子的物质为原料合成工业产品的化学工艺.查看答案和解析>>
科目: 来源: 题型:解答题
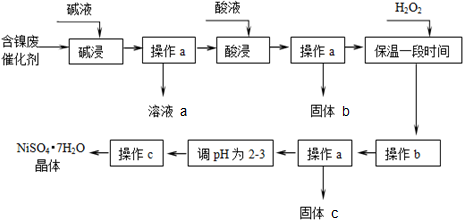
| 沉淀物 | 开始沉淀 | 完全沉淀 |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ni(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com