
科目: 来源: 题型:选择题
| A. | 物质的量 FeS:CuO:Fe=1:1:1 | |
| B. | 物质的量 C:CuO:Fe=3:2:2 | |
| C. | 质量 MnO2:CuO:C=5.5:8:1.2 | |
| D. | 质量 Fe:C:CuO=7:5:3 |
查看答案和解析>>
科目: 来源: 题型:填空题
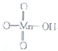 它属于强(填“强”或“弱”)酸.
它属于强(填“强”或“弱”)酸.| 化学键 | H-O | O-O | O-O |
| 键能/(J.mol-1) | 163 | 142 | 438 |
查看答案和解析>>
科目: 来源: 题型:解答题
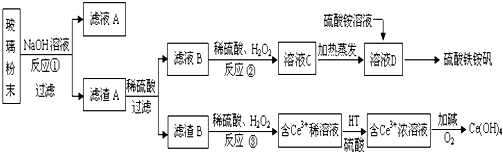
查看答案和解析>>
科目: 来源: 题型:解答题
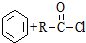 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$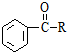 +HCl,下列是由苯制取有机物“茚”的反应过程:
+HCl,下列是由苯制取有机物“茚”的反应过程: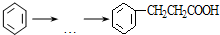 $\stackrel{SOCl_{2}}{→}$
$\stackrel{SOCl_{2}}{→}$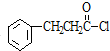 $→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$
$→_{②}^{博.克反应}$X$→_{③}^{H_{2}/催化剂}$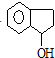 $→_{④}^{浓H_{2}SO_{4}/△}$茚
$→_{④}^{浓H_{2}SO_{4}/△}$茚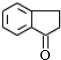 、茚
、茚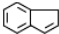 ;
;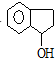 互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种)
互为同分异构体,有一苯环且苯环上有互为对位的2个取代基,并能与NaOH反应的有机物的结构简式(写出三种)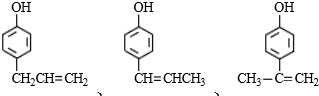 .
.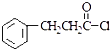 有下列性质AD
有下列性质AD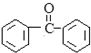 的合成路线流程图(其他无机试剂任选).
的合成路线流程图(其他无机试剂任选).查看答案和解析>>
科目: 来源: 题型:解答题
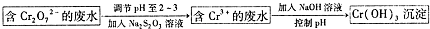
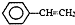 ),聚苯乙烯的化学式为
),聚苯乙烯的化学式为
查看答案和解析>>
科目: 来源: 题型:解答题
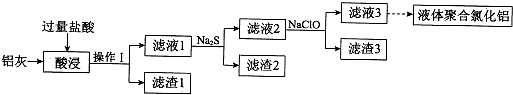
查看答案和解析>>
科目: 来源: 题型:解答题
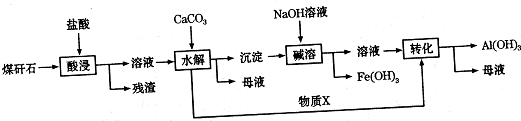
查看答案和解析>>
科目: 来源: 题型:填空题
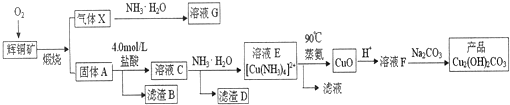
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com