
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | A、B、C三种元素形成的化合物一定是非电解质 | |
| B. | A与C只能形成化学式为A2C的化合物 | |
| C. | 第三周期中,D的原子半径最大 | |
| D. | E的氧化物对应的水化物一定具有强氧化性 |
查看答案和解析>>
科目: 来源: 题型:选择题
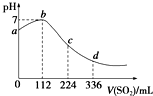
| A. | b点对应的溶液导电性最强 | |
| B. | 亚硫酸是比氢硫酸更弱的酸 | |
| C. | ab段反应是SO2+2H2S═3S↓+2H2O | |
| D. | 原H2S溶液的物质的量浓度为0.05mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
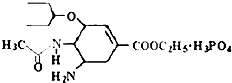 研究发现,奥司他韦可以有效治疗H1N1 流感,奥司他韦分子式为C16H28N2O4•H3PO4,分子结构如图.下列有关奥司他韦的说法中正确的是( )
研究发现,奥司他韦可以有效治疗H1N1 流感,奥司他韦分子式为C16H28N2O4•H3PO4,分子结构如图.下列有关奥司他韦的说法中正确的是( )| A. | 含极性键,易溶于水,其水溶液有丁达尔效应 | |
| B. | 分子中含有酯基、氨基、苯环等官能团 | |
| C. | 1mol 该物质最多能与3molNaOH反应 | |
| D. | 可以发生加成、取代、氧化反应、还原反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 编号 | 离子方程式或电极反应式 | 评价 | |
| A | 次氯酸钙溶液中通入足量SO2 | Ca2++C1O-+SO2+H2O=CaSO4+ C1-+2H+ | 正确 |
| B | 硫酸铁溶液与氢氧化钡溶液混合 | Fe3++SO42-+Ba2++3OH-= Fe(OH)3↓+BaSO4↓ | 正确 |
| C | 醋酸铵溶于水 | CH3COO-+NH4+?CH3COOH+NH3•H2O | 错误,阴离子水解相互促进,应该用“=”号 |
| D | 用惰性电极电解氯化铜和氯化钠的混合溶液一段时间 | 阴极:2Cu2++4e-=2Cu 阳极:4OH--4e-=2H2O+O2↑ | 错误,该阴阳两极反应不可能同时发生 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 7.8g Na2S和Na2O2的混合物中含有的阴离子数等于0.1NA | |
| B. | 12.5mL 16mol•L-1浓硫酸与足量铜反应,转移电子数为0.2NA | |
| C. | 5.6 g铁粉在0.1mol氯气中充分燃烧,转移电子数为0.3NA | |
| D. | 标准状况下,22.4 L氧气作氧化剂时转移电子数为4NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | I和Ⅱ的物质的量浓度均为0.001mol•L-1 | |
| B. | 将I稀释10倍,溶液中 c(CH3COOH)、c(OHˉ)均减小 | |
| C. | I和Ⅱ溶液混合,若c(OH-)>c(H+),则氢氧化钠过量 | |
| D. | I和Ⅱ等体积混合后,溶液中离子浓度大小为c(CH3COO-)>c(Na+)>c(H+)>c(OH--) |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com