
科目: 来源: 题型:填空题
 (对苯醌)═N2H4+
(对苯醌)═N2H4+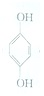 (对苯酚),N2H4的结构式为
(对苯酚),N2H4的结构式为 ,该电池正极的电极反应式为
,该电池正极的电极反应式为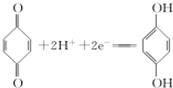 .
.| 温度/℃ | 200 | 300 | 400 |
| K | 1.0 | 0.86 | 0.5 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 外电路电子的移动方向:A→电源→B | |
| B. | 气体X在反应中通常体现还原性 | |
| C. | 电极D为惰性电极,E为活泼电极 | |
| D. | 电极D的电极反应式为C6H6+6H++6e-═C6H12 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
A | Al(OH)3用作塑料的阻燃剂 | Al(OH)3受热熔化放出大量的热 |
| B | 用氢氟酸蚀刻玻璃 | SiO2是碱性氧化物,能溶于酸 |
| C | 过氧化钠作呼吸面具中的供氧剂 | 过氧化钠是强氧化剂,能氧化二氧化碳 |
| D | 用浸有酸性高锰酸钾溶液的硅藻 土作水果保鲜剂 | 酸性高锰酸钾溶液能氧化水果释放的催熟剂乙烯 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 上述过程中,NOX只被CO还原 | |
| B. | 安装该净化器的汽车使用含铅汽油不会造成污染 | |
| C. | 产生22.4L氮气(标准状况)时,转移4xmole- | |
| D. | Pt-Rh催化剂可提高尾气平衡转化率 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol/LNa2CO3溶液中:2c(Na+)=c(HCO3-)+c(H2CO3)+c(C032-) | |
| B. | 向0.1mol/L氯化铵溶液中滴加浓盐酸可能有c(NH4+)=c(H+) | |
| C. | pH=4的醋酸与pH=10的NaOH溶液等体积混合后pH>7 | |
| D. | 将0.2mol/LNaA溶液和某浓度的盐酸等体积混合所得中性溶液中:c(Na+)=c(A-)+c(Cl-)=0.2mol/L |
查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 分子式是C13H14O4Cl2 | |
| B. | 一定条件下能发生消去反应 | |
| C. | -定条件下能发生加聚反应 | |
| D. | 1mol利尿酸最多能与5molH2发生加成反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 物 质 | 杂 质 | 试剂 | 提 纯 方 法 | |
| A | BaSO4 | BaCO3 | 水 | 溶解、过滤、洗涤 |
| B | CO2 | SO2 | 饱和Na2CO3溶液 | 洗气 |
| C | 乙酸乙酯 | 乙酸 | 稀NaOH溶液 | 混合振荡、静置分液 |
| D | 蛋白质 | 葡萄糖 | 浓(NH4)2SO4溶液 | 溶解、过滤、洗涤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 新能源汽车的推广与使用有助于减少光化学烟雾的产生 | |
| B. | 为了防止月饼等富脂食品氧化变质,常在包装袋中放入生石灰 | |
| C. | “碳纳米泡沫”倍称为第五形态的单质碳,它与石墨弧称为同位素 | |
| D. | 海水淡化能解决淡水供应危机,向海水中加入净水剂明矾可以使海水淡化 |
查看答案和解析>>
科目: 来源: 题型:解答题
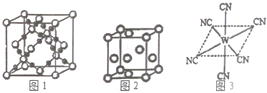 已知A、B、C、D、E、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且s轨道电子数是p轨道电子数的两倍;C原子L层上有2对成对电子.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同;W位于周期表中第8列,请回答:
已知A、B、C、D、E、W六种元素的原子序数依次递增,都位于前四周期.其中A、D原子的最外层电子数均等于其周期序数,且D原子的电子层数是A的3倍;B原子核外电子有6种不同的运动状态,且s轨道电子数是p轨道电子数的两倍;C原子L层上有2对成对电子.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同;W位于周期表中第8列,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com