
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
 -
-查看答案和解析>>
科目: 来源: 题型:解答题
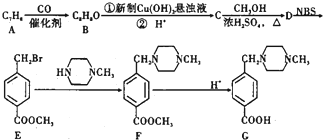
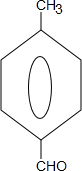

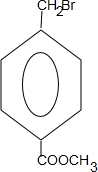 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$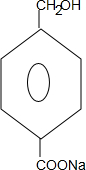 +CH3OH+NaBr
+CH3OH+NaBr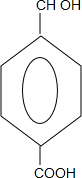 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$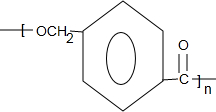 +nH2O
+nH2O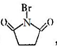 ,则关于NBS与D反应生成E的 说法错误的是 ( )
,则关于NBS与D反应生成E的 说法错误的是 ( )查看答案和解析>>
科目: 来源: 题型:选择题

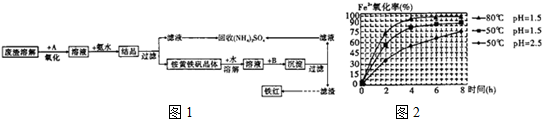
| A. | pH=2、温度为50℃、10 min时,X的物质的量浓度c( X)为5.6×10-4mol•L-1 | |
| B. | 图2说明:任何条件下X降解率均随温度升高先增后减 | |
| C. | 无需再进行后续实验,就可以判断最佳反应条件是:pH=3、温度为80℃ | |
| D. | 图1说明:50℃时,X的降解率随溶液PH的增大而逐渐减小 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该物质作净水处理剂与Cl2的作用原理完全相同 | |
| B. | 该反应表明碱性条件下ClO-氧化性强于FeO42- | |
| C. | 上述反应中Fe(0H)3与ClO-的物质的量之比应为3:2 | |
| D. | 因为FeO32-可直接水解生成氢氧化铁胶体,故可做自来水的聚凝剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
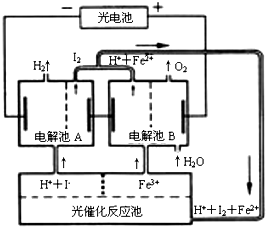
| A. | 外电路中每通过0.2 mol电子,电解池B中就会生成1.12L氧气 | |
| B. | 光催化反应池中离子反应式是:2Fe2++I2$\frac{\underline{\;光照\;}}{\;}$Fe3++2I- | |
| C. | 电解池B中阴极反应式是:Fe3++e-═Fe2+ | |
| D. | 电解池A的阳极反应式是:2I--2e-═I2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 现象或事实 | 解释 |
| A | 热的纯碱溶液去油污效果 更好 | 温度升高,增大了油脂在碳 酸钠溶液中的溶解度 |
| B | 生活中的铝制品经久耐用 | 常温时铝不与氧气反应 |
| C | 氢氧化铁胶体通直流电,阴极颜色变深 | 氛氧化铁胶体带正电荷,在电场力的作用下,胶体向阴极迁移 |
| D | 二氧化破用作通讯光缆 | 二氧化硅对光信号有良好的 传输性能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  装置:石油的分馏 | |
| B. |  装置:测定中和热 | |
| C. | 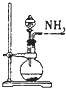 装置:将浓氨水滴加到生石灰中制取氨气 | |
| D. |  装置:加热氯化铵和消石灰混合物,制取并收集氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com