
科目: 来源: 题型:解答题
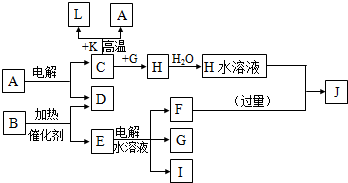
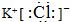 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 溴水中有平衡:Br2+H2O?HBr+HBrO 加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 | |
| C. | 高压比常压有利于合成SO3的反应 | |
| D. | 对CO(g)+NO2(g)?CO2(g)+NO(g) 平衡体系增大压强可使颜色变深 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标准状况下,18gD2O中所含的质子数为10NA | |
| B. | 标准状况下,11.2LO2参加反应转移的电子数一定为2NA | |
| C. | 28gN2和CO的混合气体中含有的分子数为NA | |
| D. | 5.6g铁与足量稀硫酸反应失去电子数为0.3NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:F<Mg<K | B. | 稳定性:PH3>H2S>NH3 | ||
| C. | 酸性:H3PO4<H2SO4<HClO4 | D. | 碱性:Al(OH)3<Mg(OH)2<KOH |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 它是一种共价化合物 | |
| B. | 在加热时此化合物不能分解 | |
| C. | 这种化合物不能跟碱反应 | |
| D. | 这种化合物可以由PH3和HI化合而成 |
查看答案和解析>>
科目: 来源: 题型:解答题
族 周期 | ⅠA | ⅡA | ⅢA | IVA | VA | VIA | VIIA | O族 |
| 1 | ||||||||
| 2 | G | H | D | |||||
| 3 | B | C | E | |||||
| 4 | F | A | ||||||
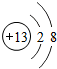 ,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3
,G元素的最高价氧化物化学式CO2,H的氢化物的化学式NH3 ;
;
查看答案和解析>>
科目: 来源: 题型:解答题
 如图所示,
如图所示,查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
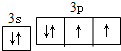 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com