
科目: 来源: 题型:选择题
| A. | 0.1mol乙炔分子中含有的共用电子对数目为0.5NA | |
| B. | 常温常压,1.6g甲烷含有的质子数为NA | |
| C. | 14g乙烯和环丙烷混合物中含有的碳原子数目为NA | |
| D. | 在标准状态下,2.24L己烷含有的氢原子数目为1.4NA |
查看答案和解析>>
科目: 来源: 题型:解答题
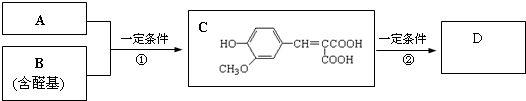
 .
.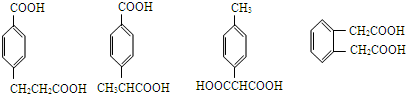 任意一种.
任意一种.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 60% | B. | 84% | C. | 42% | D. | 无法计算 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 分子式为C3H6与C6H12的两种有机物一定互为同系物 | |
| B. | 具有相同通式CnH2n+2的有机物不一定互为同系物 | |
| C. | 两个相邻同系物的分子量数值一定相差14 | |
| D. | 分子组成相差一个或几个CH2原子团的化合物必定互为同系物 |
查看答案和解析>>
科目: 来源: 题型:解答题
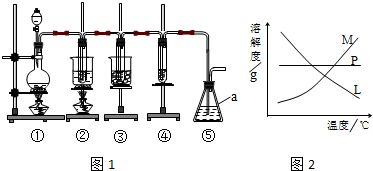
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
| 然后溶液从无色逐渐变为浅黄绿色色 | 继续通入的氯气溶于水使溶液呈浅黄绿色 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 同种元素的原子均有相同的质子数和中子数 | |
| B. | 同主族元素的简单阴离子还原性越强,水解程度越大 | |
| C. | 同周期金属元素的化合价越高,其原子失电子能力越强 | |
| D. | 短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构 |
查看答案和解析>>
科目: 来源: 题型:解答题
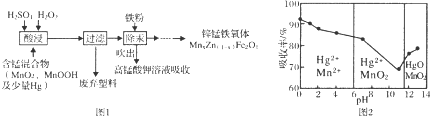
查看答案和解析>>
科目: 来源: 题型:解答题
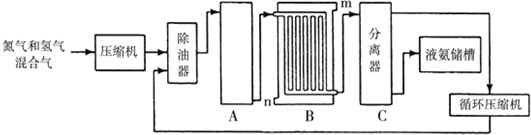
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com