
科目: 来源: 题型:选择题
| A. | 在研究物质微观结构的过程中,科学家先后使用了扫描隧道显微镜、光学显微镜、电子显微镜等观测仪器 | |
| B. | “纳米铜”具有非常强的化学活性,在空气中可以燃烧,因为它比铜片更易失去电子 | |
| C. | 室温离子液体是指在室温或接近室温下呈现的完全由阴、阳离子所组成的盐,(C2H5NH3)NO3可能是其中一种 | |
| D. | 肼、氨、甲醇燃料电池的热值远高于燃料普通燃烧的热值 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | NH4NO3→N2+O2+H2O | B. | NH4NO3→NH3+HNO3 | ||
| C. | NH4NO3→O2+HNO3+H2O | D. | NH4NO3→N2+HNO3+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 氯化氢分子的电子式: | B. | 硫化氢分子的S2-的结构示意图是: | ||
| C. | O-18原子的符号:818O | D. | CO2分子的结构式:O=C=O |
查看答案和解析>>
科目: 来源: 题型:解答题
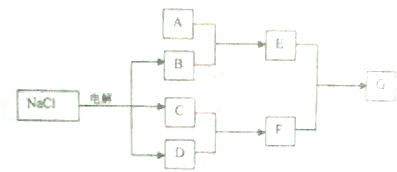
查看答案和解析>>
科目: 来源: 题型:解答题
 在一定条件下,N2(g)+H2(g)?2NH3(g),该反应的能量变化为放出92.4KJ热量,在容积为2升的密闭容器中,分别充入1molN2和1molH2,2min反应达到最大限度,三种气态物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
在一定条件下,N2(g)+H2(g)?2NH3(g),该反应的能量变化为放出92.4KJ热量,在容积为2升的密闭容器中,分别充入1molN2和1molH2,2min反应达到最大限度,三种气态物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 实验①说明Na2S2O3溶液中水电离的c(OH-)=10-8mol/L | |
| B. | Na2S2O3溶液PH=8的原因用离子方程式表示为S2O32-+2H2O═H2S2O3+2OH- | |
| C. | 生成的沉淀BaSO3或BaSO4,要进一步确认还需再加入稀硝酸验证 | |
| D. | 实验②说明Na2S2O3具有还原性 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液中:c(CH3COO-)=c(NH4+)=0.1 mol•L-1 | |
| B. | 该溶液中:c(CH3C00H)=c(NH3•H20)=c(H+)=c(OH- ) | |
| C. | 该溶液中:c(CH3COOH)-c(OH-)=c(NH3.H20)-c(H+) | |
| D. | 该溶液中:c(CH3COO-)+c(CH3C00H)=c(NH3.H20)+c(NH4+)=0.4mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com