
科目: 来源: 题型:填空题
 水中的沉淀溶解平衡曲线如图所示. 该温度下.下列说法正确的是AD.
水中的沉淀溶解平衡曲线如图所示. 该温度下.下列说法正确的是AD.查看答案和解析>>
科目: 来源: 题型:解答题
 如图的分子结构模型A(相对分子质量为M)是由4种半径依次增大的短周期元素X、Y、Z、M构成,该物质溶于水显强酸性.请回答下列问题.
如图的分子结构模型A(相对分子质量为M)是由4种半径依次增大的短周期元素X、Y、Z、M构成,该物质溶于水显强酸性.请回答下列问题.查看答案和解析>>
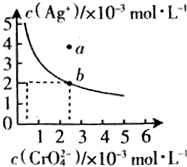
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 7:1 | B. | 7:2 | C. | 7:3 | D. | 7:4 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等pH的氨水、KOH溶液、Ba(OH)2溶液中:c(NH4+)=c(K+)=c(Ba2+) | |
| B. | 将10mL0.1mol•L-1Na2CO3溶液逐滴滴加到10mL0.1mol•L-1盐酸中:c(Na+)>c(Cl-)>c(HCO3-)>c(CO32-) | |
| C. | 向NH4HCO3溶液中滴加NaOH溶液至pH=7:c(NH4+)+c(Na+)=c(HCO3-)+c(CO32-) | |
| D. | 0.2mol•L-1的某一元弱酸HA溶液和0.1mol•L-1NaOH溶液等体积混合后的溶液:2c(OH-)+c(A-)=2c(H+)+c(HA) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 33种 | B. | 31种 | C. | 28种 | D. | 19种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1molNa2O2与水完全反应时转移电子数为NA | |
| B. | 18g重水(D2O)所含的电子数为10NA | |
| C. | 0.5molNH4HSO4晶体中,含有H+数目约为0.5NA | |
| D. | 标准状况时,1LpH=13的NaOH溶液中含有的OH-离子数为0.1NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 葡萄糖注射液能产生丁达尔效应 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 二氧化硫的大量排放是造成光化学烟雾的主要原因 | |
| D. | 汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 俄国化学家门捷列夫编制了第一个元素周期表 | |
| B. | 元素周期律是由原子核外电子排布的周期性变化引起的 | |
| C. | 在元素周期表的过渡元素区域中寻找制催化剂的元素 | |
| D. | 元素周期表中最右上角元素的非金属性最强 |
查看答案和解析>>
科目: 来源: 题型:填空题

 +2CH2=C(CH3)2→
+2CH2=C(CH3)2→ +CH2=CH.
+CH2=CH.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com