
科目: 来源: 题型:选择题
| A. | 实验表面实验室可用氨水洗涤银镜反应后的试管 | |
| B. | 实验可以证明NH3结合Ag+能力比Cl-强 | |
| C. | 浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+Cl-(aq) | |
| D. | 由资料信息科推知:加浓硝酸后生成的沉淀为AgCl |
查看答案和解析>>
科目: 来源: 题型:解答题

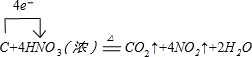 .
.| 滴定次数 | 1 | 2 | 3 | 4 |
| KMnO4溶液体积/mL | 20.60 | 20.02 | 20.00 | 19.98 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.1mol/LCH3COONa溶液与0.1mol/L HCl溶液等体积混合:c(Na+)>c(Cl-)>c(CH3COO-)>c(OH-) | |
| B. | 0.1mol/L NH4Cl溶液与0.1mol/L氨水等体积混合(pH>7):c(NH3.H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1mol/L Na2CO3与0.1mol/LNaHCO3溶液等体积混合:2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) | |
| D. | 0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | XYZ2 | B. | X2YZ3 | C. | X2YZ2 | D. | XYZ3 |
查看答案和解析>>
科目: 来源: 题型:选择题
| t/s | 0 | 50 | 150 | 250 | 350 |
| n(PCl3)mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | 反应在 前50s的平均速率v(PCl5)=0.0032mol.L-1.s-1 | |
| B. | 保持其它条件不变,升高温度,平衡时c(PCl5)=0.11mol.L-1,则该反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2反应达到平衡前v正>v逆 | |
| D. | 相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80% |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目: 来源: 题型:解答题
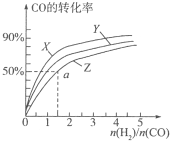 甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1
甲醇是重要的燃料,有广阔的应用前景:工业上一般以CO和为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)?CH3OH(g)△H1=-116kJ•mol-1查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com