
科目: 来源: 题型:选择题
| A. | 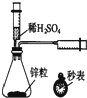 测定一定时间内生成H2的反应速率 | B. | 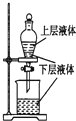 提取海带中的碘 | ||
| C. |  检验火柴燃烧产生的SO2 | D. | 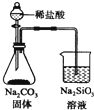 证明非金属性:Cl>C>Si |
查看答案和解析>>
科目: 来源: 题型:选择题
 >H2CO3>
>H2CO3> >HCO3-,综合考虑反应物的转化率和原料成本等因素,将
>HCO3-,综合考虑反应物的转化率和原料成本等因素,将 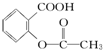 转变为
转变为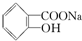 的最佳方法是( )
的最佳方法是( )| A. | 与足量的NaOH溶液共热后,再通入足量CO2 | |
| B. | 与足量的NaOH溶液共热后,再加入适量H2SO4 | |
| C. | 与稀H2SO4共热后,加入足量的NaOH溶液 | |
| D. | 与稀H2SO4共热后,加入足量的Na2CO3溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
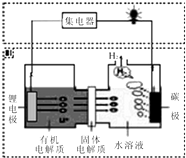 近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )
近几年科学家发明的一种新型可控电池--锂水电池,工作原理如图所示.下列有关说法不正确的是( )| A. | 碳极发生的反应是:2H2O+2e-=H2↑+2OH - | |
| B. | 有机电解质和水溶液不可以互换区域 | |
| C. | 标况下产生22.4L的氢气时,正极消耗锂的质量为14g | |
| D. | 该装置不仅可提供电能,还可得到清洁的氢气 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①是非氧化还原反应,而②是氧化还原反应 | |
| B. | 上述反应中SO2的作用只相当于催化剂 | |
| C. | 反应②中CuSO4是氧化产物 | |
| D. | 反应①中SO2发生还原反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 序号 | ① | ② | ③ | ④ |
| 溶液 | NaCl | CH3COONH4 | NaF | NaHCO3 |
| pH | 7.0 | 7.0 | 8.1 | 8.4 |
| A. | 酸性强弱:H2CO3>HF | |
| B. | ①和②中溶质均未水解 | |
| C. | 离子的总浓度:①>③ | |
| D. | ④中:c(HCO3-)+2c(CO32-)+c(H2CO3)═0.1 mol/L |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 稀硫酸和氢氧化钡溶液反应 | B. | 稀硝酸与氢氧化钠溶液反应 | ||
| C. | 醋酸与氢氧化钾溶液反应 | D. | 盐酸与氢氧化铁反应 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
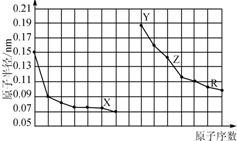
| A. | X、R的最高化合价相同 | |
| B. | 简单离子的半径:X>Y>Z | |
| C. | Y、Z、R对应的最高价氧化物的水化物相互之间可以发生反应 | |
| D. | 电解熔融的X与Z构成的化合物可以得到单质Z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com