
科目: 来源: 题型:选择题
| A. | Ca2++ClO-+SO2+H2O→CaSO4↓+Cl-+2H+ | |
| B. | Ca2++2ClO-+2SO2+2H2O→CaSO4↓+2Cl-+2H++SO42- | |
| C. | Ca2++3ClO-+3SO2+3H2O→CaSO4↓+3Cl-+6H++2SO42- | |
| D. | Ca2++3ClO-+SO2+H2O→CaSO4↓+2HClO+Cl- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液中,K+、Fe2+、I-、Br-可以大量共存 | |
| B. | 用该溶液中溶解一定量铜粉,向所得溶液中再加入铁粉,若溶液中有Cu2+,则一定没有固体析出 | |
| C. | 将该溶液蒸干,得到的固体中混有氢氧化铁 | |
| D. | 100mL 0.1 mol/L该溶液和足量的Zn充分反应,生成1.12 gFe |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 配制CuCl2溶液时,将CuCl2(s)溶于浓HCl后再加水冲稀,浓盐酸作用:有利于抑制CuCl2水解,可防止Cu(OH)2的形成 | |
| B. | 加热MnO2的浓HCl溶液制取氯气.浓盐酸作用:有利于减少氯气的溶解损失 | |
| C. | 浓硝酸不能溶解金,需用浓HCl溶液配制王水才能溶解金.浓盐酸作用:有利于增强Au的还原性,并且提高硝酸的氧化性 | |
| D. | 将浓硫酸滴入浓盐酸中制备HCl气体.浓盐酸作用:增大溶质的浓度,有利于促进平衡向气体溶解的逆方向移动 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向某溶液中加入盐酸酸化的BaCl2溶液 | 生成白色沉淀 | 该溶液中一定含有SO42- |
| B | 将少量的溴水滴入FeCl2、NaI的混合溶液中, 再滴加CCl4,振荡、静置,向上层溶液中滴 加KSCN溶液.再向上层溶液中滴加溴水 | 实验现象1: 上层溶液不变红, 下层溶液紫红色 实验现象2: 上层溶液变红 | 氧化性: Br2>Fe3+>I2 |
| C | 取久置的Na2O2粉末,向其中滴加过量的盐酸 | 产生无色气体 | Na2O2没有变质 |
| D | 浓度相同的ZnCl2、CuCl2溶液中,滴入少量Na2S溶液 | 只有黑色沉淀 | Ksp(CuS)>Ksp(ZnS) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
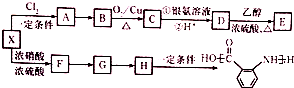
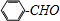 ;
; ;②
;②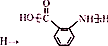 :
: ;
;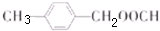 ;
;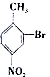 合成
合成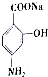 的转化流程图(写出反应物和反应条件).
的转化流程图(写出反应物和反应条件).查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石英可导电,用于生产光导纤维 | |
| B. | 常见的氮肥都属于铵盐类无机物 | |
| C. | 粗盐经过溶解、过滤、蒸发结晶,即可得到纯净物氯化钠 | |
| D. | 生活中食用的食醋、植物油、动物蛋白等物质都是混合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
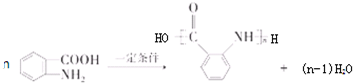
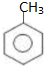
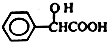 .工业上扁桃酸可以由烃A经过以下步骤合成得到:
.工业上扁桃酸可以由烃A经过以下步骤合成得到: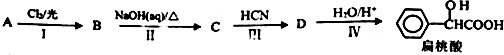
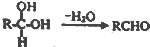
 ;扁桃酸中含氧官能团名称羟基、羧基.
;扁桃酸中含氧官能团名称羟基、羧基. .
.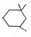 )在浓硫酸作用下反应生成,请写出反应的化学方程式
)在浓硫酸作用下反应生成,请写出反应的化学方程式
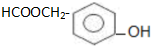 .
.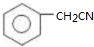 )为原料合成扁桃酸的同分异构体-对羟基苯乙酸(
)为原料合成扁桃酸的同分异构体-对羟基苯乙酸(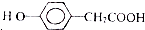 )的合理路线.
)的合理路线.查看答案和解析>>
科目: 来源: 题型:解答题
 .
.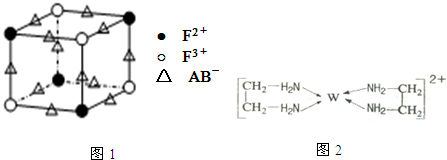
查看答案和解析>>
科目: 来源: 题型:解答题
 当今世界,能源的发展日益成为全世界、全人类共同关心的问题.
当今世界,能源的发展日益成为全世界、全人类共同关心的问题.| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 899 | 1 757 | 14 840 | 21 000 |
| B | 738 | 1 451 | 7 733 | 10 540 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com