
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
| 气体 | CO | N2 | CO2 | H2 | O2 |
| 体积(m3)(标准状况) | x | 20 | 12 | 60 | 1.0 |
| 化学式 | H2CO3 | HClO | H2C4H4O6(酒石酸) |
| 电离平衡常数 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 |
查看答案和解析>>
科目: 来源: 题型:解答题
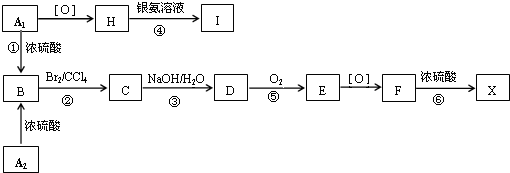
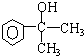 ;F
;F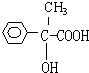 .
. ;
; .
. 、
、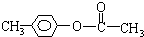 、
、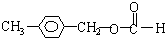 、
、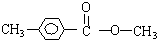 .
.查看答案和解析>>
科目: 来源: 题型:解答题

 ,该反应的类型为酯化反应.
,该反应的类型为酯化反应.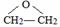 .
.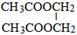 .
.查看答案和解析>>
科目: 来源: 题型:选择题
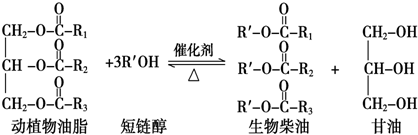
| A. | 生物柴油由可再生资源制得 | B. | 生物柴油是不同酯组成的混合物 | ||
| C. | 动植物油脂是高分子化合物 | D. | “地沟油”可用于制备生物柴油 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
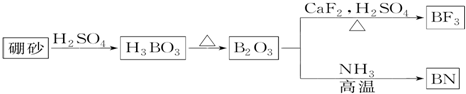
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
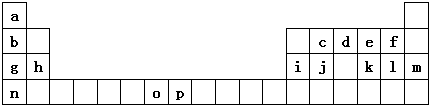
| 元素 | O | p | |
| 电离能 /kJ•mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com