
科目: 来源: 题型:解答题
 研究CO2的利用对促进低碳社会的构建具有重要的意义.
研究CO2的利用对促进低碳社会的构建具有重要的意义.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 所有主族元素的最高正化合价都等于其最外层电子数 | |
| B. | 所有过渡元素都是金属元素,所有的金属元素也都是过渡元素 | |
| C. | 在周期表中氧族元素的单质全部是气体 | |
| D. | 同周期主族元素的原子半径以ⅦA族的为最小 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | K+、CO32-、HS-、S2-、Al3+、AlO2- | B. | MnO4-、Na+、SO42-、K+、Cl- | ||
| C. | SO42-、Ag+、SO32-、S2-、AlO2-、K+ | D. | Fe3+、Cl-、H+、NO3- |
查看答案和解析>>
科目: 来源: 题型:解答题
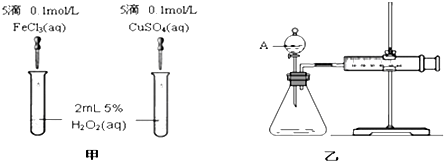
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 中和反应反应热的测定实验中,将环形玻璃搅拌棒换成环形铜丝搅拌棒测定出来的中和热值偏大 | |
| B. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6KJ/mol | |
| C. | 将0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6KJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3KJ/mol,则H2SO4和Ca(OH)2反应的反应热△H=-(2×57.3)KJ/mol |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
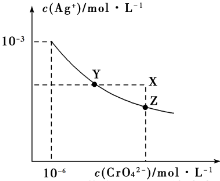
| A. | 在t℃时,Ag2CrO4的Ksp为1×10-12 | |
| B. | 在t℃时,AgCl的溶解度大于Ag2CrO4 | |
| C. | 在饱和Ag2CrO4溶液中加入K2CrO4,可使溶液由Y点到X点 | |
| D. | 在t℃时,用AgNO3标准溶液滴定20mL未知浓度的KCl溶液,不能采用K2CrO4溶液为指示剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 简单离子半径的大小顺序为:rw>rz>ry | |
| B. | 元素W的氧化物对应水化物的酸性比Y的强 | |
| C. | X与Y形成的晶体XaYa的熔点高硬度大,为可替代金刚石的材料 | |
| D. | X与W形成的化合物和Z与W形成的化合物的化学类型相同 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 规律 | 结论 |
| A | 强氧化性物质可以用来杀菌消毒 | ClO2可用于自来水消毒 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硫酸,浓硫酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3沸点低于PH3 |
| D | 较强的酸可以制取较弱的酸 | 硫化氢通入硫酸铜溶液中不能反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com