
科目: 来源: 题型:选择题
| A. | v(NH3)=0.2 mol•L-1•s-1 | B. | v(N2)=0.2 mol•L-1•min-1 | ||
| C. | v(H2)=0.2 mol•L-1•min-1 | D. | v(H2)=0.3 mol•L-1•min-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D | |
| 两极材料 | Zn片、石墨 | Cu片、Ag片 | Zn片、Cu片 | Fe片、Cu片 |
| 插入溶液 | 硫酸溶液 | 硝酸银溶液 | 蔗糖溶液 | 稀盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电时负极反应为:Zn-2e-+2OH--Zn(OH)2 | |
| B. | 放电时正极发生氧化反应 | |
| C. | 放电时每转移2mol电子,反应的锌的质量是65g | |
| D. | 放电时化学能转化为电能 |
查看答案和解析>>
科目: 来源: 题型:解答题
 Ⅰ.(1)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.
Ⅰ.(1)人们把拆开1mol化学键所吸收的能量看成该化学键的键能.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电时负极反应为:3Zn-6e-+6OH-═3Zn(OH)2 | |
| B. | 充电时阳极反应为:Fe(OH)3-3e-+5OHFeO${\;}_{4}^{2-}$+4H2O | |
| C. | 放电时每转移3 mol电子,正极有1 mol K2FeO4被还原 | |
| D. | 充电时阴极溶液的碱性减弱 |
查看答案和解析>>
科目: 来源: 题型:解答题

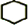 ,B名称是1,2-二溴环己烷
,B名称是1,2-二溴环己烷 +2NaOH$→_{△}^{醇}$
+2NaOH$→_{△}^{醇}$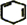 +2NaBr+2H2O.
+2NaBr+2H2O.查看答案和解析>>
科目: 来源: 题型:解答题
 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 通CO的一极是电池的正极 | |
| B. | 该电池工作过程中需不断补充CO和O2,CO2可循环利用 | |
| C. | 负极反应式为:O2+2CO2+4e-→2CO32- | |
| D. | 正极反应式为:2CO+2CO32-→4CO2+4e- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com