
科目: 来源: 题型:选择题
| A. | H+,Cu2+,Fe3+、SO4 2- | B. | Ba2+,Na+,Al3+、Cl- | ||
| C. | K+、Ag+ NH4+,NO3- | D. | Na+、K+、Br-、OH- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 容量瓶、分液漏斗、滴定管在使用府前都需要检杏是否漏水,可以用相同的方法检查是否漏水 | |
| B. | 溶液蒸发操作时蒸发皿中液体的量不能超过容积的1/2 | |
| C. | 强酸滴定强碱时,用酚酞指示剂比用甲基橙更易判断滴定终点 | |
| D. | 物质的分离提纯方法之一为“筛分”:如胶体一半透膜法分离提纯;悬浊液一过滤分离,本质上就是依椐所分离粒子的直径大小选择具有合适孔径的“筛子” |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素周期表有7个主族,8个副族,1个0族 | |
| B. | 同周期元素原子的最外层电子数相同 | |
| C. | 同主族元素从上到下原子半径依次减小 | |
| D. | 金属元素和非金属元素分界线附近的元素可用于制造半导体材料 |
查看答案和解析>>
科目: 来源: 题型:选择题
 学生设计了下图所示的方法对A盐进行鉴定
学生设计了下图所示的方法对A盐进行鉴定| A. | A中一定有Fe3+ | B. | C中一定有Cu2+ | ||
| C. | B一定为AgCl沉淀 | D. | A一定为CuCl2溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
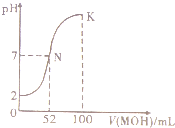 常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )
常温下,向100mL 0.0l mol.L-1HCl的溶液中逐滴加入0.02mol.L-1 MOH溶液的过程中,其pH变化如图所示(溶液体积变化忽略不计).下列说法中正确的是( )| A. | MOH为一元强碱 | |
| B. | N点水的电离程度小于K点水的电离程度 | |
| C. | 在K点,c(M+)>c(Cl-)>c(OH-)>c(H+) | |
| D. | K点对应的溶液中,有c( MOH)+c( M+)=0.02 mol.L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径是第ⅡA族中最大的 | B. | 遇冷水能剧烈反应 | ||
| C. | 位于第七周期 | D. | Ra(OH)2是两性氢氧化物 |
查看答案和解析>>
科目: 来源: 题型:解答题
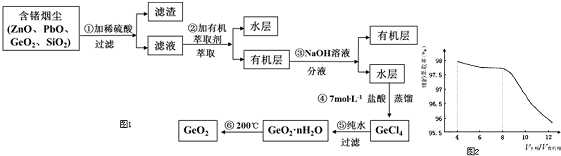
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题

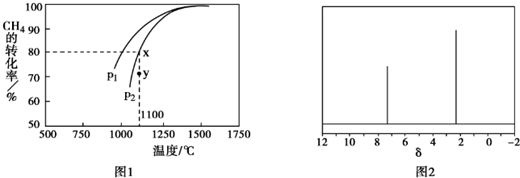
 .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com