
科目: 来源: 题型:选择题
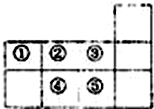
| A. | 元素①于第二周期第IVA族 | B. | 气态氢化物的稳定性:④>② | ||
| C. | 单质⑤遇足量元素①的氢化物有白烟 | D. | 元素的最高正化合价:③=⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子最外层电子数是次外层电子数2倍的元素 | |
| B. | 原子M层电子数等于L层和K层电子数之差的元素 | |
| C. | 第三周期ⅦA族的元素 | |
| D. | 最高正价和最低负价的绝对值之差为2的元素 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①②③④ | B. | ②④⑥ | C. | ①③⑤ | D. | ②④⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径由小到大的顺序:X<Y<Z<W | |
| B. | Z的最高价氧化物能与水反应生成相应的酸 | |
| C. | Y单质在一定条件下可以与氧化铁发生置换反应 | |
| D. | 室温下,0.1 mol/L w的气态氢化物的水溶液的氢离子浓度小于0.1 mol/L |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | 氢化物的还原性为H2T>H2R | |
| B. | 单质与稀盐酸反应的速率为L<Q | |
| C. | L、M、R的最高价氧化物的水化物两两之间均能反应 | |
| D. | 离子半径:L2+<R2- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 常温下,将铁片置于浓硝酸中:Fe+6HNO3=Fe(NO3)3+3NO2↑+3H2O | |
| B. | AlCl3溶液中加入过量氨水:Al3++4OH-=AlO2-+2H2O | |
| C. | 向(NH4)2SO4溶液中加入适量Ba(OH)2:Ba2++SO42-=BaSO4↓ | |
| D. | 向浓硝酸中加入铜片:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na+、Mg2+、NO3-、SO32- | B. | K+、Cl-、NO3-、Fe2+ | ||
| C. | NH4+、Al3+、NO3-、SO42- | D. | K+、Na+、HCO3-、NO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 可以用澄清石灰水鉴别SO2和CO2 | |
| B. | 硫粉在过量的纯氧中燃烧可以生成SO3 | |
| C. | SO2能使溴水、酸性KMnO4溶液褪色 | |
| D. | 少量SO2通过浓的氯化钙溶液能生成白色沉淀 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
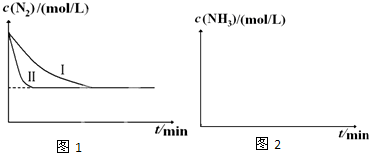
查看答案和解析>>
科目: 来源: 题型:解答题
| 阳离子 | Ag+、Na+ |
| 阴离子 | NO3-、SO42-、Cl- |
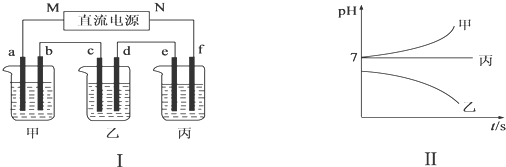
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com