
科目: 来源: 题型:选择题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | K=1.77×10-4 | K=4.9×10-10 | K1=4.3×10-7,K2=5.6×10-11 |
| A. | 在NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-) | |
| B. | 向NaCN溶液中通入少量CO2的离子方程式:2CN-+H2O+CO2=2HCN+CO32- | |
| C. | 中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者大于后者 | |
| D. | 等物质的量浓度的各溶液pH关系为:pH(NaHCO3)>pH(NaCN)>pH(HCOONa) |
查看答案和解析>>
科目: 来源: 题型:选择题
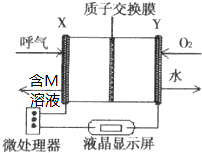 查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )
查处酒后驾驶所采用的“便携式乙醇测量仪”,以燃料电池为工作原理,如图,两电极材料均为Pt.理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为M,其中一个电极的反应式为:CH3CH2OH-2e-→M+2H+.下列说法中正确的是( )| A. | 电池内部H+向X极移动 | |
| B. | 另一极Y极的电极反应式为:O2+4e-+2H2O=4OH- | |
| C. | 乙醇在X极上发生还原反应,电子经过外电路流向Y极 | |
| D. | 电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O |
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验内容 | 实验目的 |
| A | 在食盐水中通入氟气置换出氯气 | 证明氟的非金属性强于氯 |
| B | 将滴有酚酞试液的氨水分成两份,并加热其中一份溶液 | 研究温度对弱电解质电离的影响 |
| C | 分别用玻璃棒蘸c(H+)相同的乙二酸和乙酸溶液,点在pH试纸上,并与标准比色卡对比 | 比较乙二酸和乙酸的酸性强弱 |
| D | 室温下,分别向体积、浓度均相同的Na2S2O3溶液中加入相同体积、不同浓度的稀硫酸 | 研究浓度对反应速率的影响 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
. .常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.
.常温下,D2E2是一种橙黄色的液体,遇水易水解,并产生能使品红褪色的气体.下列说法中正确的是ACD.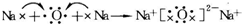 .
.查看答案和解析>>
科目: 来源: 题型:解答题
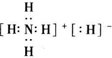 ,其中所含的化学键类型有离子键、共价键(填“离子键”、“共价键”),此化合物与足量水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.
,其中所含的化学键类型有离子键、共价键(填“离子键”、“共价键”),此化合物与足量水反应的化学方程式为NH4H+H2O=NH3•H2O+H2↑.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 晶体中105B和115B两种同位素原子的质量比为1:4 | |
| B. | 5.4 g该晶体硼所含中子为2.9 mol | |
| C. | 等质量的分别由105B和115B构成的晶体硼所含中子数之比为6:5 | |
| D. | 若碳原子质量为w g,则105B原子的质量为10w g |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | V1:V2的值 | B. | V1和V2的值 | ||
| C. | X和Y的物质的量 | D. | 盐酸和稀硫酸的物质的量浓度 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
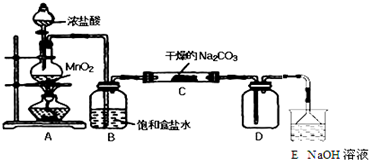
| 实 验 步 骤 | 预 期 现 象 和 结 论 |
| 步骤1:取C中的少量固体样品于试管中, 加入蒸馏水至固体溶解,然后各取1~2mL 所得溶液分别置于甲、乙两支试管中. | 得到无色溶液. |
| 步骤2:向甲试管中加入过量的BaCl2溶液, 静置. | 若溶液变浑浊,证明固体中含有Na2CO3. |
| 步骤3:取甲试管中上层清液少许于另一只 试管中,滴加少量澄清石灰水, 充分振荡. | 若上层清液变浑浊, 证明固体中含有NaHCO3. |
| 步骤4:向乙试管中先加入过量的稀HNO3 稀HNO3;再滴入少量AgNO3溶液溶液. | 若生成白色沉淀;证明固体中含有氯化钠. |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 利用分液漏斗进行分液操作时,先打开分液漏斗旋塞,使下层液体慢慢流出,待下层液体完全流出后,关闭旋塞,再将上层液体从上口倒出 | |
| B. | 用镊子夹取金属钠固体,切割取用后剩余的钠放回原试剂瓶中 | |
| C. | 用标准浓度的盐酸滴定未知浓度NaOH溶液时,酸式滴定管用蒸馏水洗净后未用同浓度盐酸润洗,将导致测定结果偏低 | |
| D. | 溶液配制、中和滴定实验中,容量瓶、锥形瓶用蒸馏水洗净后即可使用;而滴定管、移液管用蒸馏水洗净后,须再用待装液润洗2~3次后方可使用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com