
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 试管中加入少量苯,加入溴水振荡后,溴水褪色,发生了加成反应 | |
| B. | 苯能使酸性高锰酸钾溶液褪色 | |
| C. | 苯较难发生加成反应,所以通常要加入催化剂 | |
| D. | 苯不能发生取代反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | SiO2是酸性氧化物,能与溶液反应 | |
| B. | Na2CO3和NaHCO3都是盐,都能与CaCl2溶液反应 | |
| C. | CO和NO都是大气污染物,在空气中都能稳定存在 | |
| D. | Al在浓盐酸中会“钝化”,能用铝槽盛放浓盐酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
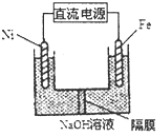
查看答案和解析>>
科目: 来源: 题型:解答题
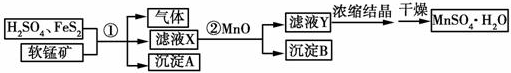
查看答案和解析>>
科目: 来源: 题型:解答题
| A | B | C | D | E | G | |
| 最低化合价 | -4 | -2 | -1 | -2 | -1 | -3 |
| 电负性 | 2.55 | 2.58 | 3.16 | 3.44 | 3.98 | 3.0 |
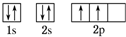 C原子的价电子排布式3s23p5
C原子的价电子排布式3s23p5查看答案和解析>>
科目: 来源: 题型:解答题
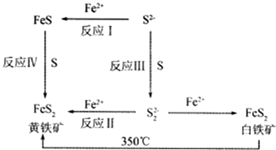 Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.
Ⅰ.Li-Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为2Li++FeS+2e-═Li2S+Fe,则该电池的总反应式为2Li+FeS═Li2S+Fe.查看答案和解析>>
科目: 来源: 题型:解答题
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
| 原子半径 (10-10m) | 1.52 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 0.71 |
| 最高价态 | +1 | +1 | -- | +3 | +4 | +5 | +7 | +1 | +5 | -- |
| 最低价态 | -- | -- | -2 | -- | -4 | -3 | -1 | -- | -3 | -1 |
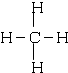 ;③和⑤形成的化合物的电子式
;③和⑤形成的化合物的电子式 ;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式
;写出元素③和⑧形成的既有离子键,又有共价键的化合物的电子式 ;
;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 其水溶液显酸性,俗称石碳酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后立即放出二氧化碳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com