
科目: 来源: 题型:选择题

| A. | 外接负载时,左槽作为原电池负极,发生氧化反应 | |
| B. | 外接电源时,左槽连接外接电源的正极,发生还原反应 | |
| C. | 负载是镀铜的电镀槽时,H+由左槽向右槽移动 | |
| D. | 充电时若转移电子数为3.01×1023个,左槽溶液中n(H+)的变化量为0.5mol |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
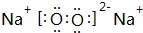 、
、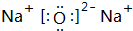 .
. .
.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
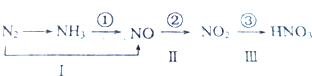
查看答案和解析>>
科目: 来源: 题型:解答题
| 难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 2.8×10-2 mol•L-1 | B. | 1.4×10-5 mol•L-1 | ||
| C. | 2.8×10-5 mol•L-1 | D. | 5.6×10-5 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com