
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 40 | B. | 18 | C. | 12 | D. | 10 |
查看答案和解析>>
科目: 来源: 题型:解答题
 2013年12月2日,我国“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察.“玉兔”月球车底盘和车轮由铝合金材料制成.看见玉兔车金灿灿的车身后,小聪同学想到家里新换的水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参加.
2013年12月2日,我国“嫦娥三号”探测器由长征三号运载火箭发射,首次实现月球软着陆和月面巡视勘察.“玉兔”月球车底盘和车轮由铝合金材料制成.看见玉兔车金灿灿的车身后,小聪同学想到家里新换的水龙头,从说明书上了解到该水龙头是铜质镀铬.好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,请你一同参加.| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 | 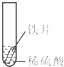 | 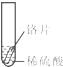 | 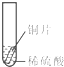 |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | 铜表面无气泡,溶液不变色 |
查看答案和解析>>
科目: 来源: 题型:多选题
| t/s | 0 | 3 | 6 | 12 | 24 |
| n(O2)/mol | 0 | 0.36 | 0.60 | 0.80 | 0.80 |
| A. | 反应在0~3 s内的平均速率v(NO2)=0.24 mol•L-1•s-1 | |
| B. | 24 s后,若保持其他条件不变,降低温度,达到新平衡时测得c(O2)=0.44 mol•L-1,则反应的△H<0 | |
| C. | 在T温度下,起始时向容器中充入1.0 mol NO2、0.5 mol O3和0.50 mol N2O5、0.50 mol O2,反应达到平衡时,压强为起始时的0.88倍 | |
| D. | 在T温度下,起始时向容器中充入2.0 mol N2O5和2.0 mol O2,达到平衡时,N2O5的转化率大于20% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ③⑤⑥⑦ | B. | ③④⑥ | C. | ②④⑤⑧ | D. | ①③④⑧ |
查看答案和解析>>
科目: 来源: 题型:解答题

 | V(0.5mol•L-1 HCl)/mL | m(CaCO3)/g | CaCO3状态 | V(蒸馏水)/mL | 实验目的 | |
| 实验1 | 40.0 | 0.8 | ①实验1和2探究固体表面积对反应速率的影响; ②实验1和3探究反应物浓度对反应速率的影响 | |||
| 实验2 | 40.0 | 0.8 | ||||
| 实验3 | 60.0 | 0.8 |
查看答案和解析>>
科目: 来源: 题型:多选题
| t/s | 0 | 50 | 150 | 250 | 350 |
| N(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
| A. | T℃时,该反应的平衡常数K=0.05mol•L-1 | |
| B. | 0-50s内反应的平均反应速率v(Cl2)=0.0032mol•L-1•s-1 | |
| C. | 其他条件不变,升高温度,平衡时c(PCl3)=0.12mol•L-1,则该反应的△H<0 | |
| D. | T℃时,若起始充入1.0molPCl5、0.2molPCl3和0.2molCl2,则起始时v(正)>v(逆) |
查看答案和解析>>
科目: 来源: 题型:解答题
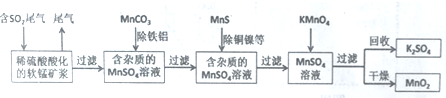
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质是Na2O. |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入适量BaCl2 | 有白色沉淀生成 | 白色物质是Na2CO3 |
| ②静置片刻,取上层清液于试管中… | …. |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com