
科目: 来源: 题型:解答题
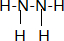
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某钠盐溶液含甲电离出的阴离子,则该溶液只能与酸反应 | |
| B. | 丁和甲中各元素质量比相同,则丁中一定含有-l价的元素 | |
| C. | 丙中含有第二周期ⅣA族的元素,则丙一定是只含C、H的化合物 | |
| D. | 乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | W、Y的原子序数a>c | B. | 离子的还原性Y2-<Z- | ||
| C. | 原子最外层电子数Y<W | D. | 离子半径X+>Z- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 | |
| B. | 锡在常温下以灰锡状态存在 | |
| C. | 灰锡转化为白锡的反应是放热反应 | |
| D. | 灰锡和白锡的相互转化互为可逆反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 硫原子的原子结构示意图: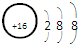 | |
| B. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O | |
| C. | NH4Cl的电子式: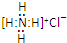 | |
| D. | 高氯酸(HClO4)中氯元素的化合价为+5 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | HCl具有很强的酸性,所以氯元素的非金属性很强 | |
| B. | ${\;}_{17}^{35}$Cl、${\;}_{17}^{37}$Cl为不同的核素,有不同的化学性质 | |
| C. | 1.12LCl2含有1.7NA个质子(NA 表示阿伏加德罗常数) | |
| D. | 氯气可从KI溶液中置换出I2,说明氯的非金属性比碘强 |
查看答案和解析>>
科目: 来源: 题型:解答题
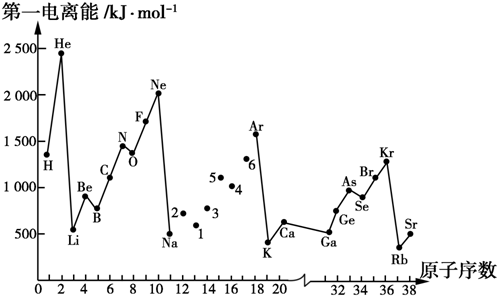
查看答案和解析>>
科目: 来源: 题型:解答题
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素 电离能/kJ•mol-1 | X | Y | Z |
| I1 | 496 | 738 | 577 |
| I2 | 4 562 | 1 451 | 1 817 |
| I3 | 6 912 | 7 733 | 2 754 |
| I4 | 9 540 | 10 540 | 11 578 |
| A. | 三种元素中,X元素的第一电离能最小,其电负性在同一周期元素中也最小 | |
| B. | 三种元素中,Y元素的第一电离能最大,其电负性也最大 | |
| C. | 等物质的量的X、Y、Z三种单质与少量盐酸反应时放出的氢气的物质的量之比为1:1:1 | |
| D. | 三种单质与盐酸反应放出等量氢气时,消耗X、Y、Z的物质的量之比为3:2:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 在元素周期表中,铝的周期数是其主族序数的2倍 | |
| B. | 铝原子的基态电子排布图为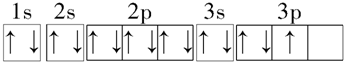 | |
| C. | 同周期,铝、钙所在主族的元素的原子序数之差只为1或11 | |
| D. | 工业上冶炼金属铝的方法是电解熔融的Al2O3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com