
科目: 来源: 题型:解答题
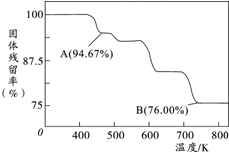 铬元素及其化合物在生产、生活中具有广泛的用途.
铬元素及其化合物在生产、生活中具有广泛的用途.查看答案和解析>>
科目: 来源: 题型:选择题
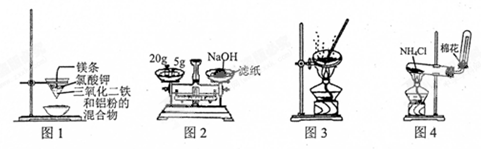
| A. | 用图1装置制取金属铁 | |
| B. | 用图2装置称量NaOH固体 | |
| C. | 用图3装置蒸干CuCl2饱和溶液制备CuCl2晶体 | |
| D. | 用图4装置制取氨气 |
查看答案和解析>>
科目: 来源: 题型:选择题
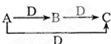 ,则A、D可能是( )
,则A、D可能是( )| A. | ①②③ | B. | ④⑤ | C. | ①②④ | D. | ①②③⑤ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该电池不宜在高温下工作 | |
| B. | 若该电池为酸性介质,正极反应式为:O2+4e-+4H+═2H2O | |
| C. | 放电过程中,电池内阳离子向正极迁移 | |
| D. | 若该电池为碱性介质,以葡萄糖为原料并完全氧化,负极反应式为:C6H12O6-24e-+6H2O═6CO2↑+24H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 单质硅化学性质稳定,但自然界不存在游离态的硅 | |
| B. | 氨气的水溶液能导电,说明氨气是电解质 | |
| C. | SO2使溴水或品红溶液褪色,体现了SO2的漂白性 | |
| D. | 镁、铝、铜等金属一般采用热还原法冶炼 |
查看答案和解析>>
科目: 来源: 题型:多选题
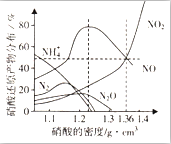 某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )
某些金属与不同密度的硝酸反应时,往往生成多种不同价态的还原产物,如图是在相同条件下,各种不同密度的硝酸和铁反应时,还原产物的分布图.通过图象判断下列说法不正确的是( )| A. | 稀硝酸与铁反应,一定有NO生成 | |
| B. | 密度小于1.1g•cm-3的硝酸与铁反应,还原产物百分率最多的是NH4+ | |
| C. | 某硝酸试剂瓶的标签注明:密度为1.26g•cm-3,质量分数50.0%;若取该试剂10ml配成100ml溶液,所得溶液pH=1 | |
| D. | 当硝酸的密度为1.36g•cm-3时,过量铁与硝酸反应,消耗的铁与被还原的硝酸物质的量之比为1:1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c(Fe2+):c(Fe3+)=3:1 | B. | c(Fe3+):c(Cu2+)=4:3 | ||
| C. | c(CI-)=6mol/L,c(Fe2+)=0.6mol/L | D. | 该绝缘板腐蚀后质量减少0.384g |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 溶液中一定有K+、Br-、CO32-、AlO2- | |
| B. | 溶液中一定没有Mg2+、Cu2+、Cl-、NH4+ | |
| C. | 不能确定溶液中是否有K+、SO42-、Cl- | |
| D. | 往第3份溶液中滴加BaCl2可确认是否有SO42- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 某温度下,任何电解质的稀溶液中,pC(H+)+pC(OH-)=14 | |
| B. | 0.01mol/L的CaCl2溶液中逐滴加入纯碱溶液,滴加过程中pC(Ca2+)逐渐增大 | |
| C. | 0.01mol/L的BaCl2 溶液中,pC(Cl-)=2pC(Ba2+) | |
| D. | 用0.01mol/L的盐酸滴定某浓度的NaOH溶液,NaOH溶液的pC(OH-)逐渐减小 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 灼烧过程中使用的玻璃仪器有酒精灯、坩埚、玻璃棒 | |
| B. | 氧化过程中发生反应的离子方程式为:2I-+H2O2→I2+2OH- | |
| C. | 检验碘单质时,可选用淀粉碘化钾试纸,若试纸变蓝说明有碘单质 | |
| D. | 分液时,先打开活塞放出下层液体,再关闭活塞倒出上层液体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com