
科目: 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质都是天然高分子化合物 | |
| B. | 用福尔马林(甲醛溶液)浸泡海产品,可长时间保鲜 | |
| C. | 粮食酿酒主要经过淀粉→葡萄糖→乙醇的化学变化过程 | |
| D. | 明矾既可用于净水,也可杀菌消毒 |
查看答案和解析>>
科目: 来源: 题型:填空题
 (g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高温\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$
(g)+3H2(g)$\frac{\underline{\;\;\;\;\;\;\;\;\;高温\;\;\;\;\;\;\;\;\;}}{Fe_{3}O_{4}/Al_{2}O_{3}}$ (g)
(g) 
查看答案和解析>>
科目: 来源: 题型:选择题
| 选项 | 实验器材(省略夹持装置) | 相应实验 |
| A | 烧杯、玻璃棒、坩埚、坩埚钳、酒精灯、三脚架 | 灼烧FeCl3固体 |
| B | 烧杯、玻璃棒、胶头滴管、漏斗、滤纸、带铁圈的铁架台 | 用NaOH溶液除去Fe粉中少量Al |
| C | 烧杯、玻璃棒、胶头滴管、容量瓶、量筒 | 用10mol•L-1的硫酸配置0.1mol•L-1的硫酸 |
| D | 烧杯、玻璃棒、胶头滴管、分液漏斗 | 用溴水和CCl4除去NaBr溶液中的少量NaI |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | X、M两元素最简单氢化物的稳定性:X<M | |
| B. | Z、W、M的单质均能与稀硫酸反应制取氧气,且反应剧烈程度依次减弱 | |
| C. | Y的最高价含氧酸的化学式为H2YO2 | |
| D. | W和M的氧化物均可作耐高温材料 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应的速率主要①决定 | B. | HClI是该反应的催化剂 | ||
| C. | v(H2)=v(HCl)=v(I2) | D. | a值越小,该反应速率越快 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 使用LED照明灯属于“低碳生活”方式 | |
| B. | 在家用电热水器不锈钢内胆镶嵌镁棒,以防止内胆被侵蚀 | |
| C. | 施用适量石灰乳可降低盐碱地(含较多NaCl,Na2CO3) | |
| D. | 研制高性能的耐磨轮胎,可减少细颗粒物(PM2.5)的产生 |
查看答案和解析>>
科目: 来源: 题型:选择题
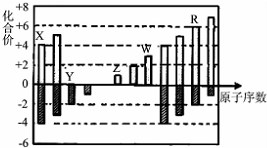
| A. | 离子半径:W3+>Z+>Y2- | |
| B. | X、Y、R都存在同素异形现象 | |
| C. | Z和Y形成的化合物只存在离子键 | |
| D. | 常温下单质W能溶于R的最高价氧化物对应水化物的浓溶液 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 序号 | 堆积方式 | 晶胞棱长(cm) |
| Ⅰ | 面心立方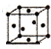 | a |
| Ⅱ | 体心立方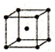 | b |
查看答案和解析>>
科目: 来源: 题型:解答题
| H2CO3 | Ka1=4.3×10-7 | HClO | Ka=2.95×10-8 |
| Ka2=5.61×10-11 | AgCl | Ksp=1.77×10-10 | |
| CH3COOH | Ka=1.76×10-5 | Ag2CrO4 | Ksp=1.12×10-12 |
| Ⅰ | Ⅱ | Ⅲ | Ⅳ | |
| FeCl3溶液体积/mL | 100 | 100 | 100 | 100 |
| 加入粉末质量/g | 3 | 6.6 | 9 | 12 |
| 剩余粉末质量/g | 0 | 0.64 | 3.2 | 6.4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com