20.某研究性学习小组对苹果“生锈”(新切开的苹果表面颜色逐渐变深)的原因进行探讨(注:题中所述颜色变化均已做过对比实验,不会因试剂本身而产生干扰).
[查阅资料]鲜苹果中营养物质的含量(mg/100g):蛋白质200-400,铁0.1-0.3,总糖1300-1500,并含有多酚及黄酮类天然化学抗氧化物质.
[提出假设]苹果“生锈”的可能原因:
假设1:由所含铁元素被氧化生成铁的氧化物或氢氧化物而形成;
假设2:由所含多酚被氧化而形成:
假设3:可能由所含铁元素和所含多酚被氧化共同形成.
[设计实验,验证假设]
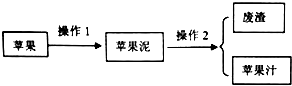
取所得苹果汁进行以下实验:
(1)经测定,鲜苹果汁的pH为3.48.
(2)观察,苹果汁呈黄色,加入少许某不能与盐酸反应的黑色颗粒,果汁的颜色明显变浅.将果汁分为4份分别进行下列实验.
(3)第一份滴加少许KSCN溶液,未见红色,加入适量H
2O
2,仍未见红色,充分加热,液体的颜色反而变为无色,同时有气泡产生,再滴入少许FeCl
2溶液,液体变为红色.
(4)第二份滴加足量溴水,有少量沉淀生成,静置后,倾出上层液体,固体经洗涤后成白色,在倾出的上层液体中滴加少许KSCN溶液,也未见红色,再滴入少许CCl
4充分振荡后,静置,下层液体呈棕黄色.
(5)第三份加入少许稀HNO
3,充分加热,试管中出现红棕色气体,液体的颜色明显变深,放置一段时间后,液体的颜色逐渐变浅,但仍比加入HNO
3前深,再滴加少许KSCN溶液,液体变为红色.
(6)配制相同体积的与(5)中放置一段时间后的液体颜色相近的FeCl
3溶液,滴加与(5)中等量的KSCN溶液,溶液的红色比(5)中明显深许多.另取一只苹果,灼烧成灰,加入稀HCl充分搅拌后,取所得液体,滴入KSCN溶液,液体变为红色.
完成下列问题:
(1)假设3:可能由所含铁元素和所含多酚被氧化共同形成;
(2)完成操作1所用仪器的名称是研钵,经操作2后,所得苹果汁仍很浑浊,所作的处理是重复过滤,测定鲜苹果汁pH时所用的仪器或用品是pH计;
(3)处理苹果汁时所加的黑色颗粒可能是活性炭;
(4)实验(3)体现了H
2O
2的哪些性质(要求写两点)强氧化性(或漂白性)、不稳定性;
(5)通过实验(4)可推测,苹果中含有哪类物质多酚;实验中设置加入CCl
4的目的是证明加入的Br
2已经足量;
(6)对比实验(3)和实验(5),你能得出的结论是硝酸的氧化性强于过氧化氢;对比实验(5)和实验(6),说明苹果汁中所含的营养物质是蛋白质;
(7)实验(5)中试管中出现红棕色气体的可能原因是(要求写两点)硝酸分解生成二氧化氮、稀硝酸被苹果中还原性物质还原为NO,NO与氧气反应生成二氧化氮;
(8)通过实验,你认为苹果中的“铁”以何种形式存在苹果中Fe与有机物结合在一起.

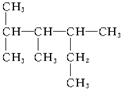 的物质,其名称是( )
的物质,其名称是( )
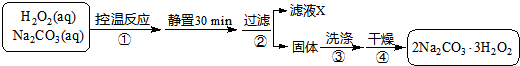 图1
图1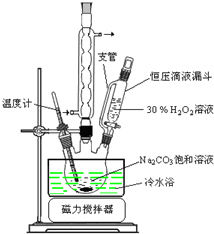
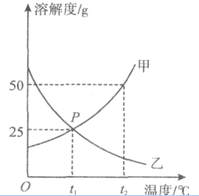 如图为甲、乙两种物质的溶解度曲线图,请根据图回答下列问题.
如图为甲、乙两种物质的溶解度曲线图,请根据图回答下列问题.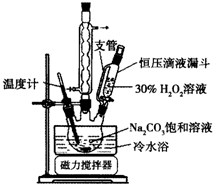 2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.
2Na2CO3•3H2O2是一种新型的氧系漂白剂.某实验兴趣小组进行了如下实验.