
科目: 来源: 题型:解答题
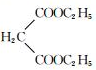 $→_{CH_{3}CH_{2}ONa}^{BrCH_{2}CH_{2}CH_{2}Br}$
$→_{CH_{3}CH_{2}ONa}^{BrCH_{2}CH_{2}CH_{2}Br}$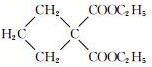 $→_{ii.H+/△}^{i.H_{2}O,OH-}$
$→_{ii.H+/△}^{i.H_{2}O,OH-}$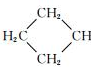 -COOH
-COOH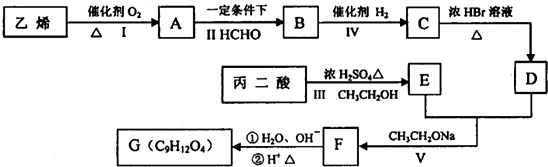
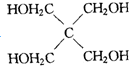 G
G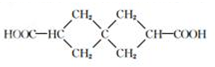
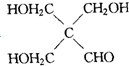
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 等压时,通入惰性气体,c的物质的量不变 | |
| B. | 等压时,通入z气体反应器中温度升高 | |
| C. | 等容时,通入惰性气体,各反应速率不变 | |
| D. | 等容时,通入z气体,通入z气体的转化率较小 |
查看答案和解析>>
科目: 来源: 题型:选择题
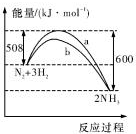
| A. | 该反应的热化学方程式为:2NH3?N2+3H2△H=-92kJ.mol-1 | |
| B. | 生成物的能量之和比反应物的能量之和高 92 kJ | |
| C. | a曲线是未加入催化剂时的能量变化曲线 | |
| D. | 加入催化剂可增加正反应速率,减小逆反应速率 |
查看答案和解析>>
科目: 来源: 题型:解答题
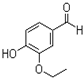 乙基香兰素是一种合成香料,其结构简式如图:
乙基香兰素是一种合成香料,其结构简式如图:
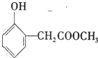 、
、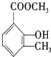 ;
;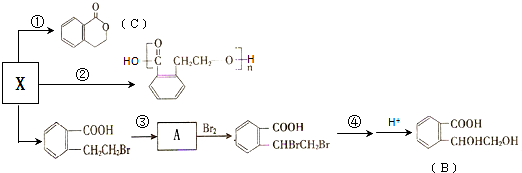
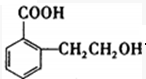 ;B中含氧官能团的名称羟基、羧基;
;B中含氧官能团的名称羟基、羧基; .
.查看答案和解析>>
科目: 来源: 题型:选择题
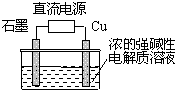 Cu2O是一种半导体材料,制取Cu2O的电解池如图,总反应为:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )
Cu2O是一种半导体材料,制取Cu2O的电解池如图,总反应为:2Cu+H2O$\frac{\underline{\;通电\;}}{\;}$Cu2O+H2↑.下列说法不正确的是( )| A. | 铜电极发生氧化反应 | |
| B. | 铜电极接直流电源的负极 | |
| C. | 石墨电极上产生氢气 | |
| D. | 每生成1molCu2O时,就有2mol电子转移 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 无色溶液:Cu2+、K+、MnO4-、SO42- | |
| B. | 能溶解Al2O3的溶液:Na+、Ca2+、HCO3-、NO3- | |
| C. | 常温下c(OH-)=1×10-13mol•L-1的溶液:NH4+、Al3+、SO42-、Cl- | |
| D. | 含0.1 mol•L-1 NO3-的溶液:H+、Fe2+、Mg2+、Br- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放热反应一定能自发的进行 | |
| B. | SO2能使品红溶液和溴水褪色,说明SO2具有漂白性 | |
| C. | 将AlCl3溶液和Al2(SO4)3溶液分别蒸干灼烧,所得产物的成分均为Al2O3 | |
| D. | 由反应AgCl(s)+KI(aq)?AgI(s)+KCl(aq)可知Ksp(AgCl)>Ksp(AgI) |
查看答案和解析>>
科目: 来源: 题型:填空题

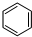 -CH3(g)+11H2△H=kJ•mol-1.
-CH3(g)+11H2△H=kJ•mol-1.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com