
科目: 来源: 题型:解答题
 .
.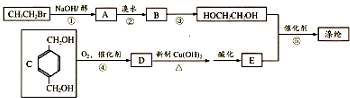
 ,反应①、②的反应类型分别为消去反应、加成反应,有机物B的名称是1,2-二溴乙烷,反应③可用的试剂为氢氧化钠水溶液;
,反应①、②的反应类型分别为消去反应、加成反应,有机物B的名称是1,2-二溴乙烷,反应③可用的试剂为氢氧化钠水溶液; ;
; ;
; ;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构有4种.
;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构有4种.查看答案和解析>>
科目: 来源: 题型:多选题
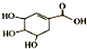
| A. | 分子式为C7H6O5 | B. | 可发生取代反应 | ||
| C. | 可使酸性高锰酸钾溶液褪色 | D. | 不能与溴水发生加成反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
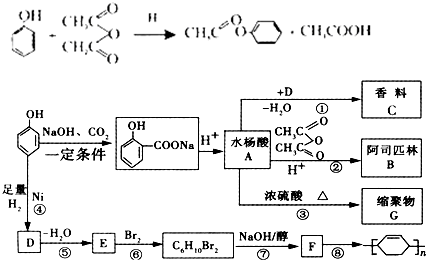
 .
. ;
;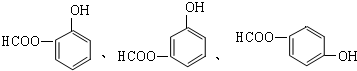 .
.查看答案和解析>>
科目: 来源: 题型:解答题
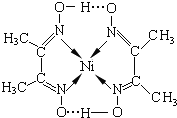 分子内含有的作用力有ACE(填序号).
分子内含有的作用力有ACE(填序号).查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 气态氢化物的稳定性:X<Z<W | |
| B. | X、Z、W氧化物对应水化物酸性的强弱顺序为Z<X<W | |
| C. | 室温下,含Y元素的盐形成的水溶液其pH<7 | |
| D. | Z元素的单质和氧化物均既能与NaOH溶液反应也能与某种酸反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:查看答案和解析>>
科目: 来源: 题型:解答题

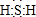 ;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化2H2S+O2 =2S↓+2H2O;该变化体现出硫元素的非金属性比氧元素弱(填“强”或“弱”).用原子结构解释原因氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱.
;其水溶液长期在空气中放置容易变浑浊,用化学方程式表示该变化2H2S+O2 =2S↓+2H2O;该变化体现出硫元素的非金属性比氧元素弱(填“强”或“弱”).用原子结构解释原因氧和硫同主族,同主族元素最外层电子数相同,从上到下,电子层数增多,原子半径增大,得电子能力逐渐减弱. .该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为NaHSO3.室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是③>①>④>②.(用编号表示)
.该法吸收快,效率高.若在操作中持续通入含SO2的烟气,则最终产物为NaHSO3.室温下,0.1mol/L ①亚硫酸钠 ②亚硫酸氢钠 ③硫化钠 ④硫化氢钠的四种溶液的pH由大到小的顺序是③>①>④>②.(用编号表示)查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 一定含有Al,其质量为4.5g | |
| B. | 一定不含FeCl2,可能含有MgCl2和AlCl3 | |
| C. | 一定含有MgCl2和FeCl2 | |
| D. | 一定含有(NH4)2SO4和MgCl2,且物质的量相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
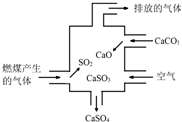
| A. | 使用此装置可以减少导致酸雨的气体的排放 | |
| B. | 该装置内既发生了化合反应,也发生了分解反应 | |
| C. | 总反应可表示为:2SO2+2CaCO3+O2→2CaSO4+2CO2 | |
| D. | 若排放的气体能使澄清石灰水变浑浊,说明该气体中含SO2 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. |  装置可比较硫、碳、硅三种元素的非金属性强弱 | |
| B. |  装置可除去CO2中少量的SO2杂质 | |
| C. | 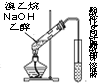 装置可用于检验溴乙烷与NaOH的醇溶液共热产生的乙烯 | |
| D. | 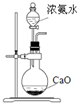 装置可用于实验室制备氨气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com