
科目: 来源: 题型:选择题
| A. | 浊液中存在沉淀溶解平衡:AgCl(s)?Ag+(aq)+CI-(aq) | |
| B. | 实验可以证明NH3结合Ag+能力比Cl-强 | |
| C. | 实验表明实验室可用氨水洗涤银镜反应后的试管 | |
| D. | 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=5的H2S溶液中,c(H+)=c(HS一)=1×10-5mol•L-1 | |
| B. | 含有AgCl和AgI固体的悬浊液中,c(Ag+)>c(Cl-)=c(I-) | |
| C. | 在新制氯水中加入氯化钠固体,水的电离平衡不移动 | |
| D. |  若R为Zn,则如图采用了牺牲阳极的阴极保护法 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 由SO2通入Ba(NO3)2溶液产生白色沉淀可知,BaSO3不溶于硝酸 | |
| B. | 电解精炼铜,电解结束后电解质溶液浓度不变 | |
| C. | 海水中Na+、Cl一结晶成NaCl的过程,形成了化学键 | |
| D. | 任何可逆反应,其平衡常数越大,反应速率、反应物的转化率就越大 |
查看答案和解析>>
科目: 来源: 题型:解答题


查看答案和解析>>
科目: 来源: 题型:填空题
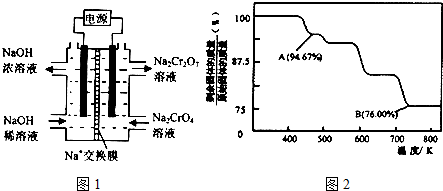
查看答案和解析>>
科目: 来源: 题型:选择题
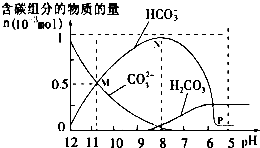 25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )
25℃时在10mL 0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示.下列说法不正确的是( )| A. | HCl溶液滴加一半时,溶液pH>7 | |
| B. | 当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1mol•L-1 | |
| C. | 0.1 mol•L-1Na2CO3溶液中c(Na+)+c(H+)=c(OH-)+2c(CO32-)+c(HCO3-) | |
| D. | 在M点:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+) |
查看答案和解析>>
科目: 来源: 题型:选择题
| | X | | Y | |
| R |
| A. | 五种元素中原子半径最大的是W,离子半径最大的是R离子 | |
| B. | X、R、W三种元素的最高价氧化物所对应的水化物的酸性强弱关系为R>W>X | |
| C. | Y与Z形成的化合物一定是碱性氧化物 | |
| D. | Z与W形成的化合物水溶液可能显酸性 |
查看答案和解析>>
科目: 来源: 题型:选择题
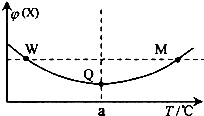 在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)═3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如右图所示.下列推断正确的是( )
在某2L恒容密闭容器中充入2mol X(g)和1mol Y(g)发生反应:2X(g)+Y(g)═3Z(g)△H,反应过程中持续升高温度,测得混合体系中X的体积分数与温度的关系如右图所示.下列推断正确的是( )| A. | M点时,Y的转化率最大 | |
| B. | 升高温度,平衡常数减小 | |
| C. | 平衡后充入Z达到新平衡时Z的体积分数增大 | |
| D. | W,M两点Y的正反应速率相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用饱和氯化铵溶液可以清洗金属表面的锈 | |
| B. | NOx、Cl2、PM2.5颗粒都会导致酸雨 | |
| C. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 | |
| D. | 人体摄入大量铝盐易患“老年性痴呆”,明矾不宜大量作净水剂 |
查看答案和解析>>
科目: 来源: 题型:填空题
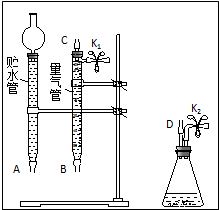 某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.
某课外活动小组对“外界条件对铜与稀硝酸反应速率的影响”作了如下探究.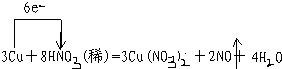 .
.| 实验 编号 | 稀硝酸的浓度/(mol/L) | 稀硝酸的体积/mL | 温度 /℃ | 时间 /min | 收集气体 的体积/mL |
| ① | a | V | 25 | t1 | V1 |
| ② | V | ||||
| ③ | V |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com