
科目: 来源: 题型:选择题
| A. | ①②④ | B. | ①③④ | C. | ②④⑥ | D. | ②⑤⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 石蕊溶液呈蓝色的溶液:K+、Na+、NO3-、Cl- | |
| B. | 无色透明溶液中:MnO4-、K+、Na+、NO3- | |
| C. | 与铝反应产生大量氢气的溶液:Na+、K+、NH4+、NO3- | |
| D. | 酸性溶液中:Al3+、Na+、SO42-、HCO3- |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 物质的量浓度为0.5mol•L-1的MgCl2溶液中,含有Cl-个数为1 NA | |
| B. | 标准状况下,11.2 L S03含有的分子数为0.5NA | |
| C. | 1 mol Na2O2含离子数为4NA | |
| D. | 24 g O2分子和24 g O3分子所含的氧原子数目相等 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 类比对象 | 结论 | |
| A | Cl2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$HCl+HClO | I2+H2O$\frac{\underline{\;\;△\;\;}}{\;}$HI+HIO |
| B | C+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$2Cu+CO2↑ | C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+CO2↑ |
| C | Na2O+H2O=2NaOH | CuO+H2O=Cu(OH)2 |
| D | Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO | Ca(ClO)2+SO2+H2O=CaSO3↓+2HClO |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:解答题
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量吸收液于试管中,滴加3mol.L-1 H2SO4至溶液呈酸性,然后将所得溶液分置于A、B试管中 | |
| 步骤2:向A试管中滴加1-2滴0.01mol.L-1KMnO4溶液. | 溶液呈浅紫色,则证明不存在SO32-, 则证明不存在SO32-. |
| 步骤3:向B试管中滴加1-2滴淀粉-KI溶液. | 溶液不变蓝色, 则证明不存在ClO-. |
查看答案和解析>>
科目: 来源: 题型:解答题
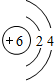 ,元素C在周期表中的位置为第三周期ⅣA族,E的元素名称为氯.
,元素C在周期表中的位置为第三周期ⅣA族,E的元素名称为氯.查看答案和解析>>
科目: 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | ⑩ | ||||||
| 2 | ⑥ | ⑦ | ||||||
| 3 | ② | ③ | ④ | ⑧ | ||||
| 4 | ⑤ | ⑨ |
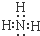 .
.查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 原子半径Z>Y | |
| B. | 同周期元素中Y的金属性最弱 | |
| C. | 同主族元素中X的氢化物稳定性最高 | |
| D. | 同周期元素中Z的最高价氧化物的水化物酸性最强 |
查看答案和解析>>
科目: 来源: 题型:多选题
| 实验事实 | 结论 | |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | 将SO2通入Ba(NO3)2溶液,有白色沉淀生成 | BaSO3难溶于硝酸 |
| C | Na2SiO3溶液中通CO2气体出现浑浊 | 酸性:H2SiO3<H2CO3 |
| D | 浓硫酸使蔗糖变黑 | 浓硫酸有脱水性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 钾与水的反应比钠与水的反应更剧烈 | |
| B. | 溴单质与水的反应比氯单质与水的反应更剧烈 | |
| C. | 随核电荷数的增加,碱金属元素和卤素的原子半径都逐渐增大 | |
| D. | 碱金属元素中,锂原子失去最外层电子的能力最弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com