
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | H2O、HD、C3H8 | B. | P2O5、CO2、H3PO4 | C. | SO2、SiO2、CS2 | D. | CCl4、(NH4)2S、H2O2 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 化学键只存在于分子内,分子间作用力只存在于分子间 | |
| B. | 分子晶体在熔化时,共价键没有被破坏 | |
| C. | 在晶体里有阳离子存在时,不一定有阴离子存在 | |
| D. | 物质在溶于水的过程中,化学键一定会被破坏或改变 |
查看答案和解析>>
科目: 来源: 题型:选择题
 和化学式中M分别代表阳离子,图中
和化学式中M分别代表阳离子,图中 和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )
和化学式中N分别代表阴离子,则化学式为MN的晶体结构为( )| A. | 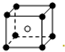 | B. | 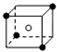 | C. | 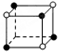 | D. | 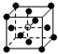 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 回收废旧电池 | |
| B. | 将工厂烟囱加高,减少周围大气污染 | |
| C. | 开发利用氢能源 | |
| D. | 推广使用无磷洗涤剂 |
查看答案和解析>>
科目: 来源: 题型:解答题
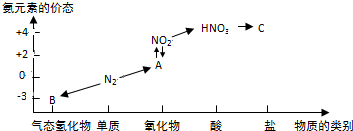
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com