
科目: 来源: 题型:选择题
| A. | 乙烯能发生加成反应,而乙烷不能发生加成反应 | |
| B. | 甲苯能使酸性高锰酸钾溶液褪色,而甲烷不能使酸性高锰酸钾溶液褪色 | |
| C. | 乙醇中的乙基对羟基的影响,使羟基的活性变弱,电离H+的能力不及H2O | |
| D. | 苯酚中的羟基氢能与NaOH溶液反应,而醇羟基氢不能与NaOH溶液反应 |
查看答案和解析>>
科目: 来源: 题型:选择题
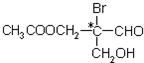 是某有机物分子的结构简式,其中带“*”的碳原子就是手性碳原子.当此有机物分别发生下列反应后,生成的有机物分子中仍含有手性碳原子的是( )
是某有机物分子的结构简式,其中带“*”的碳原子就是手性碳原子.当此有机物分别发生下列反应后,生成的有机物分子中仍含有手性碳原子的是( )| A. | 与乙酸发生酯化反应 | B. | 与NaOH水溶液反应 | ||
| C. | 催化剂作用下与H2反应 | D. | 与银氨溶液作用发生银镜反应 |
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题

查看答案和解析>>
科目: 来源: 题型:选择题
| A. | c=$\frac{dS}{142(S+100)}$ mol•L-1 | B. | S=$\frac{142W}{180W+322Y}$g | ||
| C. | X=YS | D. | W=$\frac{3220X}{1420-18S}$g |
查看答案和解析>>
科目: 来源: 题型:填空题
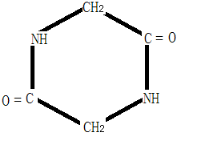 ,M与HCl反应的离子方程式为NH2CH2COOH+H+=
,M与HCl反应的离子方程式为NH2CH2COOH+H+=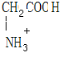 .
.查看答案和解析>>
科目: 来源: 题型:解答题
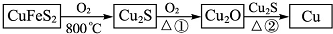
查看答案和解析>>
科目: 来源: 题型:解答题
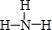 .
. ;一种由B、C组成的化合物与AC2电子总数相等,其化学式为N2O.
;一种由B、C组成的化合物与AC2电子总数相等,其化学式为N2O.查看答案和解析>>
科目: 来源: 题型:解答题
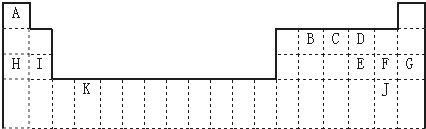
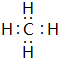 ,其空间构型为正四面体.
,其空间构型为正四面体. .
.查看答案和解析>>
科目: 来源: 题型:解答题
 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com