
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
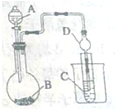 某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.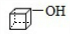 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 苯 | B. | 乙基(-CH2CH3) | C. | 碳正离子[(CH3)3C+] | D. | 碳烯(:CH2) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3Br | B. | CH3CH2CH2CH2Br | C. | CH2BrCH2Br | D. | CH3CHBrCH2CH2Br |
查看答案和解析>>
科目: 来源: 题型:填空题
 在容积为10L的密闭容器中通入一定量的SO2和O2,450℃时发生反应:2SO2+O2?2SO3(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示.请回答下列问题:
在容积为10L的密闭容器中通入一定量的SO2和O2,450℃时发生反应:2SO2+O2?2SO3(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示.请回答下列问题:| 改变的条件 | v正 | v逆 |
| ①减小SO2的浓度 | 减小 | 不变 |
| ②减小SO3的浓度 | 不变 | 减小 |
| ③缩小容器的体积 | 增大 | 增大 |
| ④加入V2O5作催化剂 | 增大 | 增大 |
查看答案和解析>>
科目: 来源: 题型:填空题
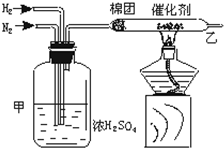 实验室中可用如图所示的装置合成NH3.
实验室中可用如图所示的装置合成NH3.查看答案和解析>>
科目: 来源: 题型:填空题
 ;D、E的最高价氧化物对应水化物发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O; A、C形成的化合物中,C的质量分数最高的化合物的结构式H-O-O-H;A有多种同位素,其中一种同位素原子核内有两个中子,这种同位素原子的符号是31H或T.
;D、E的最高价氧化物对应水化物发生反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O; A、C形成的化合物中,C的质量分数最高的化合物的结构式H-O-O-H;A有多种同位素,其中一种同位素原子核内有两个中子,这种同位素原子的符号是31H或T. 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com