
科目: 来源: 题型:解答题
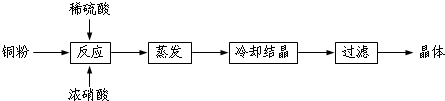
查看答案和解析>>
科目: 来源: 题型:解答题
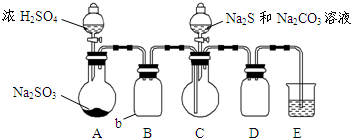 硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).
硫代硫酸钠是一种重要的化工产品.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3•5H2O).查看答案和解析>>
科目: 来源: 题型:解答题
 CO的应用和治理是当今社会的热点问题.
CO的应用和治理是当今社会的热点问题.| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
查看答案和解析>>
科目: 来源: 题型:选择题
 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )| A. | 溶液的质量减小程度:乙<甲 | |
| B. | 溶液的导电能力变化:甲>乙 | |
| C. | 甲中阴极和乙中镁电极上析出物质质量:甲=乙 | |
| D. | 电极反应式:甲中阳极:2Cl--2e→Cl2↑,乙中正极:Cu2++2e→Cu |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应条件下,碳酸氢钠难溶于水 | B. | 氨气和二氧化碳均来自合成氨工厂 | ||
| C. | 侯氏制碱法实现了对氨气循环利用 | D. | 生产时,应先通二氧化碳再通氨气 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:填空题
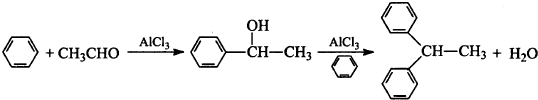
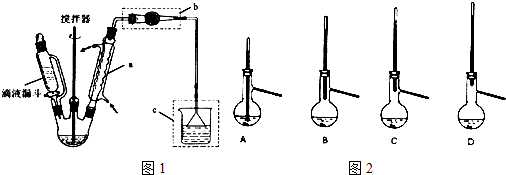
查看答案和解析>>
科目: 来源: 题型:解答题
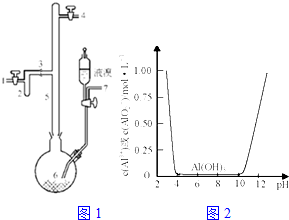 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.查看答案和解析>>
科目: 来源: 题型:填空题


查看答案和解析>>
科目: 来源: 题型:填空题

 )发生缩聚反应产物的结构简式为
)发生缩聚反应产物的结构简式为 ;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为
;P物质的钠盐在适当条件下氧化为芳香醛Q,则Q与银氨溶液发生反应的化学方程式为 .
.
 ;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为
;A、B可以发生类似①的反应生成有机物Ⅰ,则该反应的化学方程式为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com