
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:填空题
 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. |  如图可表示水分解过程中的能量变化 如图可表示水分解过程中的能量变化 | |
| B. | 若2C(s)+O2(g)=2CO(g)△H=-221.0 kJ/mol,则碳的燃烧热为110.5 kJ/mol | |
| C. | 需要加热的反应一定是吸热反应,常温下能发生的反应一定是放热反应 | |
| D. | 已知:Ⅰ:对于反应:H2(g)+Cl2(s)=2HCl (g)△H=-a kJ/mol, Ⅱ: 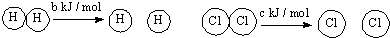 且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为-a-b-c 且a、b、c均大于零,则断开1 mol H-Cl键所需的能量为-a-b-c |
查看答案和解析>>
科目: 来源: 题型:选择题
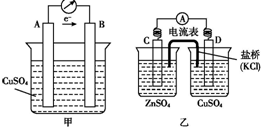
| A. | 若设计成图甲所示的原电池,电极A、B分别是Zn、Cu | |
| B. | 若设计成图乙所示的原电池,D电极反应式为:Cu2++2e-═Cu | |
| C. | 原电池乙工作时,盐桥中的K+移向CuSO4溶液,Cl-移向ZnSO4溶液 | |
| D. | 其他条件相同时,原电池甲比原电池乙的可储存时间长 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 构成原电池正极和负极的材料必须是金属 | |
| B. | 在原电池中,电子流出的一极是负极,该电极被还原 | |
| C. | 实验室欲快速制取氢气,可利用粗锌与稀H2SO4反应 | |
| D. | 原电池可以把物质内部的能量全部转化为电能 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 20% | B. | 40% | C. | 60% | D. | 80% |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CH3COCH2Cl | B. | CCl4 | C. | COCl2 | D. | CH2ClCOOH |
查看答案和解析>>
科目: 来源: 题型:解答题
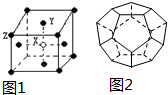 (1)下列4种物质熔点沸点由高到低排列为①>④>③>②(填序号)
(1)下列4种物质熔点沸点由高到低排列为①>④>③>②(填序号)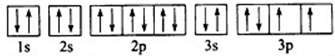 .其最高价氧化物对应的水化物的化学式是H2SO4.
.其最高价氧化物对应的水化物的化学式是H2SO4.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①② | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com