
科目: 来源: 题型:解答题
 ,1个O22+中含有2个π键.
,1个O22+中含有2个π键.查看答案和解析>>
科目: 来源: 题型:选择题
 可以被KMnO4的酸性溶液氧化生成,
可以被KMnO4的酸性溶液氧化生成, ,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不被氧化,现有分子式是C12H18的二烷基取代苯则它可以被氧化为
,但若烷基R中直接与苯环连接的碳原子上没有C-H键,则不被氧化,现有分子式是C12H18的二烷基取代苯则它可以被氧化为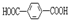 的异构体有( )
的异构体有( )| A. | 13种 | B. | 14种 | C. | 15种 | D. | 16种 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 微粒半径:O2-<F-<Na+<Li+ | B. | 第一电离能:He<Ne<Ar | ||
| C. | 分子中的键角:CH4>H2O>CO2 | D. | 共价键的键能:C-C<C=C<C≡C |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 放电时,Na+向负极移动 | |
| B. | 放电时,正极上发生的反应为xS+2Na++2e-=Na2Sx | |
| C. | 充电时,阳极上发生的反应为2Na-2e-=2Na+ | |
| D. | 放电时,每有0.4mol电子转移,则有9.2gNa和6.4g硫参加反应 |
查看答案和解析>>
科目: 来源: 题型:解答题
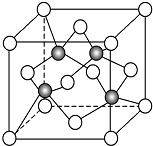 碳及其化合物与人类关系密切
碳及其化合物与人类关系密切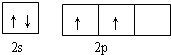 ,C、N、O三元素的第一电离能由大到小的顺序为N>O>C,在丙烯分子中碳原子的杂化方式为sp2、sp3.
,C、N、O三元素的第一电离能由大到小的顺序为N>O>C,在丙烯分子中碳原子的杂化方式为sp2、sp3.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 1 mol 乙烯分子中含有的σ 键数目为5NA | |
| B. | 1 mol甲基(-CH3)中含有电子的数目为10NA | |
| C. | 标准状况下,1L戊烷在空气中完全燃烧生成$\frac{5}{22.4}$L的CO2 | |
| D. | 14 g乙烯和丙烯的混合物中含有的氢原子总数为3NA |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ②③两步都是氧化还原反应 | B. | 只有第②步是氧化还原反应 | ||
| C. | 该方法对生产设备基本没有腐蚀 | D. | 该方法对环境污染较小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com