
科目: 来源: 题型:选择题
| A. | v(C)=0.5mol/(L•min) | B. | x=3 | ||
| C. | B的转化率为25% | D. | 平衡时C的体积分数为28.6% |
查看答案和解析>>
科目: 来源: 题型:解答题
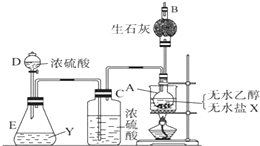 为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.
为证明乙醇分子中含有氧原子,现采用一套装置进行实验.试根据装置示意图、试剂及实验现象,回答有关问题.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 镶嵌冰密度不可能比4℃水大 | |
| B. | 镶嵌冰中四角形环比八角形环中水分间的氢键键能强 | |
| C. | 每个水分子形成两个氢键 | |
| D. | 镶嵌冰属于分子晶体 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) | B. | c(HC2O4-)+c(C2O42-)=0.1mol•L-1 | ||
| C. | c(C2O42-)>c(H2C2O4) | D. | c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
查看答案和解析>>
科目: 来源: 题型:解答题
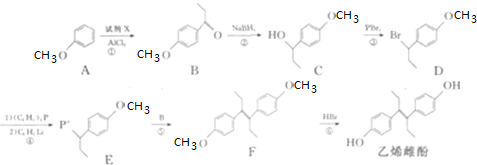
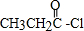 ;
;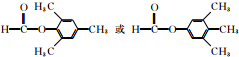 (任写一种).
(任写一种).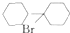 可由
可由 经五步反应合成:
经五步反应合成: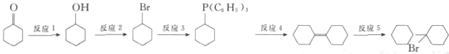
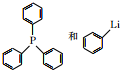 (写结构简式);
(写结构简式);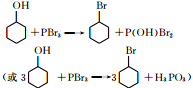 ;
;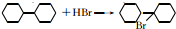 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:
已知A、B、C、D、E、F是周期表中前四周期的六种元素,它们的性质或结构信息如表,请根据信息回答下列问题:| 元素 | 性质或结构信息 |
| A | 单质为黄色粉末,难溶于水,能形成2种二元含氧酸 |
| B | M层有1个未成对的p电子,核外电子总数大于7 |
| C | 与锂形成的合金常用于航天飞行器,单质能溶于强酸和强碱 |
| D | S电子总数比p电子总数少2个,单质或氧化物均具有很高的熔、沸点 |
| E | 周期表中电负性最大的元素 |
| F | 最外层有2个电子,但次外层有18个电子 |
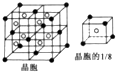
 .
.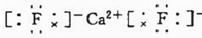 .已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).
.已知该化合物晶胞$\frac{1}{8}$的体积为2.0×10-23cm3,该离子化合物的密度为3.2g/cm3(保留一位小数).查看答案和解析>>
科目: 来源: 题型:解答题
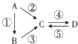 Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.
Ⅰ.A、B、C、D均为中学化学常见的纯净物,其中A是单质,它们之间有如图的转化关系.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | △H2<△H3 | B. | △H1>△H3 | C. | △H1+△H3=△H2 | D. | △H1+△H2>△H3 |
查看答案和解析>>
科目: 来源: 题型:选择题
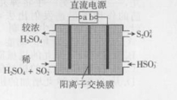 利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )
利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2,下列叙述错误的是( )| A. | a为直流电源的正极 | |
| B. | 阴极的电极反应式为:2HSO3-+e-=S2O42-+H2O | |
| C. | 阳极的电极反应式为:SO2+2H2O-2e-=SO42-+4H+ | |
| D. | 电解时,H+由阳极室通过阳离子交换膜到达阴极室 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | pH=a的醋酸溶液稀释10倍后,其pH=b,则b=a+1 | |
| B. | 浓度相同的①NH4Cl;②CH3COONH4;③NH4HSO4三种溶液的c(NH4+):①>③>② | |
| C. | 浓度相同的氨水与盐酸等体积混合:c(NH4+)>c(Cl-)>c(H+)>c(OH-) | |
| D. | 将amol•L-1CH3COOH与bmol•L-1NaOH溶液等体积混合,测得溶液pH为7,则a>b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com