
科目: 来源: 题型:选择题

| A. | 碘元素的质子数为53 | |
| B. | 碘原子的质量数为126.9 | |
| C. | 碘原子核外有5种不同能量的电子 | |
| D. | 碘原子最外层有7种不同运动状态的电子 |
查看答案和解析>>
科目: 来源: 题型:解答题
 甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.
甲醇是一种重要的化工原料,广泛应用于化工生产,也可以直接用作燃料.| 化学键 | C-H | H-H | C-O | C=O | H-O |
| 键能/kJ•mol-1 | a | b | c | d | e |
| 容器 | 反应物投入的量 | 反应物的转化率 | CH2OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1molCO和2molH2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1molCH3OH | a2 | c2 | 放出Q2kJ热量 |
| 丙 | 2molCO和4molH2 | a3 | c3 | 放出Q3kJ热量 |
查看答案和解析>>
科目: 来源: 题型:填空题

| 晶体 | NaCl | KCl | CaO |
| 晶格能/(Kj.mol-1) | 786 | 715 | 3401 |

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
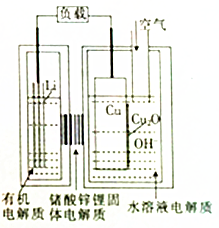 近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )
近年来AIST报告正在研究一种“高容量、低成本”锂-铜空气燃料电池.该电池通过一种复杂的铜腐蚀“现象”产生电力,其中放电过程为2Li+Cu2O+H2O=2Cu+2Li++2OH-,下列说法不正确的是( )| A. | 放电时,Li+透过固体电解质向Cu极移动 | |
| B. | 放电时,负极的电极反应式为Cu2O+H2O+2e-=Cu+2OH- | |
| C. | 通空气时,铜被腐蚀,表面产生Cu2O | |
| D. | 整个反应过程中,铜相当于催化剂 |
查看答案和解析>>
科目: 来源: 题型:选择题
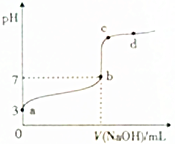 常温下,向20mL0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
常温下,向20mL0.1mol•L-1CH3COOH溶液中逐滴加入0.1mol•L-1NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中:c(H+)>c(CH3COO-)>c(OH-) | |
| B. | b点时,V(NaOH)=20mL | |
| C. | c点表示的溶液中:c(H+)+c(Na+)=c(OH-)+c(CH3COO-) | |
| D. | d点表示的溶液中:c(Na+)>c(CH3COO-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将钠粒投入CuSO4溶液中:2Na+Cu2+=Cu+2Na+ | |
| B. | 将NaHSO4溶液滴加到含有酚酞的Ba(OH)2溶液中,溶液由红色变成无色:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| C. | 将少量醋酸加入到NaAlO2溶液中:CH3COOH+AlO2-+H2O=CH3COO-+Al(OH)3↓ | |
| D. | 硫化钠溶液中加入少量的氯化铁溶液:S2-+2Fe3+=2Fe2++S↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com