
科目: 来源: 题型:解答题

 .
. (其中一种).
(其中一种). )的合成路线.
)的合成路线.查看答案和解析>>
科目: 来源: 题型:解答题
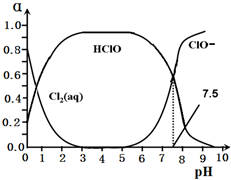 元素周期表中ⅦA族元素的单质及其化合物的用途广泛.
元素周期表中ⅦA族元素的单质及其化合物的用途广泛.查看答案和解析>>
科目: 来源: 题型:多选题
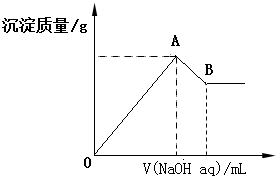
| A. | x=$\frac{2a}{5-a}$ | |
| B. | x的取值范围是0<x<$\frac{11}{32}$ | |
| C. | A点横坐标的值随x发生变化 | |
| D. | 若B点横坐标为200mL时,c(NaOH)=7.0mol/L |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | H2S+2NO3-+2H+=2NO2↑+S↓+2H2O | |
| B. | 3 H2S+2NO3-+2H+=2NO↑+3S↓+4H2O | |
| C. | 3Fe3++3NO3-+6H2S=3NO↑+6S↓+3Fe2++6H2O | |
| D. | Fe3++3NO3-+5H2S+2H+=3NO↑+5S↓+Fe2++6H2O |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 测定某二元弱酸钠盐溶液的pH,可能小于7 | |
| B. | 稀释0.1mol/LCH3COOH(aq),$\frac{c(O{H}^{-})c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$可能变大也可能变小 | |
| C. | 在20.00ml浓度均为0.100 mol/L的HCl与CH3COOH混合溶液中滴加0.200mol/LNaOH溶液至pH=7,NaOH溶液体积一定小于20.00ml | |
| D. | pH=8的碱性溶液中一定没有CH3COOH分子 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 最高价含氧酸酸性:X<Y | B. | X、Y、Z可形成离子化合物 | ||
| C. | W可形成双原子分子 | D. | M与W形成的化合物含极性共价键 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 转移的电子数是0.1NA | B. | 反应后液体质量减少1.6g | ||
| C. | 生成的气体中含有0.8mol中子 | D. | 生成气体的体积是1.12L |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 反应①中还原产物只有SO2 | |
| B. | 反应②中Cu2S只发生了氧化反应 | |
| C. | 将1 molCu2S冶炼成 2mol Cu,需要O21mol | |
| D. | 若1molCu2S完全转化为2molCu,则转移电子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 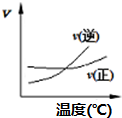 A2(g)+3B2(g)?2AB3(g)如图说明此反应的正反应是吸热反应 | |
| B. | 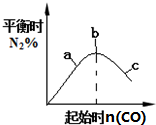 4CO(g)+2NO2(g)?N2(g)+4CO2(g)如图说明NO2的转化率b>a>c | |
| C. |  N2(g)+3H2(g)?2NH3(g)如图说明t秒时合成氨反应达到平衡 | |
| D. |  2A(g)+2B(g)?3C(g)+D(?)如图说明生成物D一定是气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com