
科目: 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③④⑤⑥⑦ | C. | ①②④⑤⑨ | D. | ①②③⑤⑧ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该反应的正反应为放热反应 | |
| B. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 反应的热化学方程式可表示为:CO(g)+H2O(g)$\frac{\underline{\;\;催化剂\;\;}}{高温高压}$CO2(g)+H2(g)△H<0 kJ/mol |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ${\;}_{2}^{3}He$原子核内有2个中子 | |
| B. | ${\;}_{2}^{3}He$原子核外有3个电子 | |
| C. | ${\;}_{3}^{4}He$原子核内有3个质子 | |
| D. | ${\;}_{2}^{3}He$和${\;}_{2}^{4}He$是两种不同的核素 |
查看答案和解析>>
科目: 来源: 题型:解答题
| R | Q | ||
| M | T |
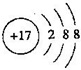 ; 元素M在元素周期表中的位置是第三周期第VIA族.
; 元素M在元素周期表中的位置是第三周期第VIA族.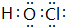 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 非金属元素的原子最外层电子数都大于或等于4 | |
| B. | 只有非金属能形成含氧酸或含氧酸盐 | |
| C. | Na2O2中阴阳离子的个数比为1:1 | |
| D. | 非金属元素组成的化合物不一定是共价化合物 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na[Al(OH)4]溶液中通入过量CO2:2[Al(OH)4]-+CO2+3H2O=2Al(OH)3↓+CO32- | |
| B. | 往碳酸镁中滴加稀盐酸:CO32-+2H+═CO2↑+H2O | |
| C. | 氧化铜溶于稀盐酸中:CuO+2H+=Cu2++2H2O | |
| D. | 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
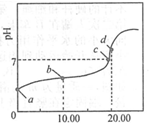 常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )
常温下,用0.01mol•L-1NaOH溶液滴定20.00mL0.01mol•L-1CH3COOH溶液,所得滴定曲线如图.下列说法正确的是( )| A. | a点PH=2 | |
| B. | b点对应的溶液中:c(OH-)+c(CH3COO-)=c(Na+)+c(H+) | |
| C. | c点表示NaOH溶液与CH3COOH溶液恰好完全反应 | |
| D. | d点对用的溶液中,水的电离程度小于同温下纯水的电离程度 |
查看答案和解析>>
科目: 来源: 题型:填空题

| 实验序号 | 盐酸标准液体积(mL) | 所消耗氢氧化钠标准液的体积(mL) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 2.00 | 22.00 |
| 3 | 20.00 | 1.00 | 20.80 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com