
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | AgCl水溶液的导电性很弱,所以AgCl是弱电解质 | |
| B. | 所有盐类都能促进水的电离 | |
| C. | 碳酸钠溶液加水稀释过程中,溶液中各离子浓度都减小 | |
| D. | 将1 mL pH=3的HX溶液稀释到10 mL,若溶液的pH<4,则HX为弱酸 |
查看答案和解析>>
科目: 来源: 题型:解答题
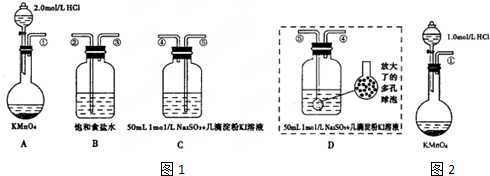
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
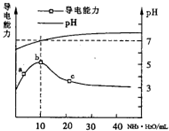 常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,
常温下向10mL0.1mol/L的HR溶液中逐滴滴人0.1 mol/L的NH3•H2O溶液,| A. | a~b点导电能力增强说明HR为弱酸 | |
| B. | b点溶液pH=7说明NH4R没有水解 | |
| C. | c 点溶液存在c(NH4+)>c(R-)、c(OH-)>c(H+) | |
| D. | b-c任意点溶液均有c(H+)×c(OH-)=KW=1.0×10-14 |
查看答案和解析>>
科目: 来源: 题型:解答题
 实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:
实验室中有一未知浓度的稀盐酸,某学生测定盐酸的浓度在实验室中进行实验.请完成下列填空:| 实验编号 | NaOH溶液的浓度 | 滴定完成时,NaOH溶液滴入的体积/mL | 待测盐酸的体积/mL |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目: 来源: 题型:解答题
| 第一份 | 第二份 | 第三份 | |
| 样品的质量/g | 7.54 | 15.08 | 35.00 |
| 二氧化硫的体积/L | 0.672 | 1.344 | 2.688 |
| 硫的质量/g | 0.8 | 1.6 | 3.2 |
查看答案和解析>>
科目: 来源: 题型:解答题
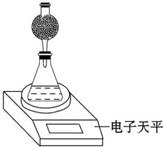 某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.限选试剂:1.00mol•L-1 HNO3、2.00mol•L-1 HNO3,细颗粒大理石、粗颗粒大理石,35℃水浴.| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol•L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com