
科目: 来源: 题型:选择题
| A. | 6个碳原子有可能都在同一直线上 | |
| B. | 在同一直线上的碳原子可能为4个 | |
| C. | 分子中所有原子有可能都在同一平面上 | |
| D. | 6个碳原子不可能都在同一平面上 |
查看答案和解析>>
科目: 来源: 题型:解答题

查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H | ||||
| 4 | J |
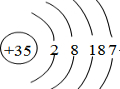 .
.查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 检验SO42-:加入BaCl2溶液出现白色沉淀,再加足量稀HCl沉淀不溶解 | |
| B. | 检验Cl-:确定无SO42-后,加入AgNO3溶液出现白色沉淀,加入足量稀HNO3沉淀不溶解 | |
| C. | 检验Na+:将干净的铂丝蘸取少量溶液在酒精灯上灼烧,观察火焰呈黄色 | |
| D. | 检验NH4+:滴入NaOH溶液后,加热,用湿润蓝色石蕊试纸检验发现变红 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | |
| B. | 元素金属性:B>A,元素非金属性:D>C | |
| C. | 离子半径:D(n+1)->Cn->B(n+1)+>An+ | |
| D. | 原子序数:b>a>c>d |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 当A、B都是金属,A的还原性一定比B强 | |
| B. | 当A、B都是非金属时,A的非金属性一定比B强 | |
| C. | 当A是金属时,B可能是金属,也可能是非金属 | |
| D. | 当A是非金属时,B可能是非金属,也可能是金属 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 都可以保存在煤油中 | B. | 随电子层数增加,熔沸点逐渐降低 | ||
| C. | 都是银白色金属,质软,有延展性 | D. | 随电子层数增加,密度逐渐增大 |
查看答案和解析>>
科目: 来源: 题型:解答题
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com