
科目: 来源: 题型:解答题
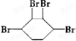
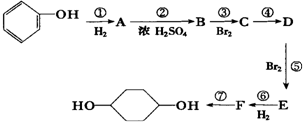 已知实验室由
已知实验室由 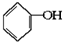 合成
合成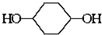 的反应流程如下 (部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基)
的反应流程如下 (部分试剂和反应条件已略去) (X代表卤素原子,R代表烃基) 、D
、D
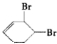 、
、
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 3,3-二甲基-2-戊烯 | B. | 2-甲基-4-乙基-1-己烯 | ||
| C. | 3-甲基-2-戊烯 | D. | 2,2-二甲基丁烷 |
查看答案和解析>>
科目: 来源: 题型:解答题
 合成氨是人类科学技术上的一项重大突破,其反应原理为:
合成氨是人类科学技术上的一项重大突破,其反应原理为:查看答案和解析>>
科目: 来源: 题型:解答题
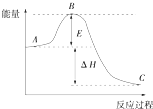 2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g) 被氧化为1mol SO3(g)的△H=-99kJ/mol.回答下列问题:
2SO2(g)+O2(g)═2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g) 被氧化为1mol SO3(g)的△H=-99kJ/mol.回答下列问题:查看答案和解析>>
科目: 来源: 题型:多选题

| A. | 反应方程式中的x=1,30min时改变条件后,A的转化率将变减小 | |
| B. | 前30 min内 A的反应速率为0.05 mol/(L•min) | |
| C. | 20至40 min内表示处于平衡状态,该反应为放热反应 | |
| D. | 30 min时改变的条件是加入负催化剂,40 min时改变的条件是升高温度 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③⑥ | C. | ②③⑤ | D. | ②④⑥ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Y2为0.1 mol•L-1 | B. | X2为0.1 mol•L-1 | ||
| C. | Y2为0.35 mol•L-1 | D. | Z为0.3 mol•L-1 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | △H>0表示放热反应,△H<0表示吸热反应 | |
| B. | 反应产物的总焓大于反应物的总焓时,△H>0 | |
| C. | △H的大小与热化学方程式中的各物质的化学计量数无关 | |
| D. | 在化学反应中,发生物质变化的同时不一定发生能量变化 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | CO2的水溶液导电能力很弱,所以CO2是弱电解质 | |
| B. | 强电解质一定是易溶于水的化合物,弱电解质一定是难溶于水的化合物 | |
| C. | 在水溶液中能离解为自由移动的离子的化合物是电解质 | |
| D. | 在强电解质的水溶液中只有离子没有分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com