
科目: 来源: 题型:选择题
| A. | 燃烧、酸碱中和反应都是放热反应 | |
| B. | 化学反应必然伴随着能量的变化 | |
| C. | 需要加热才能发生的反应一定是吸热反应 | |
| D. | 反应物总能量和生成物总能量的相对大小决定了反应是放出能量还是吸收能量 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 高强度、质量轻 | B. | 耐热、抗高温 | C. | 耐腐蚀、稳定性好 | D. | 导电、导热性好 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 天然气、液化石油气、沼气的主要成分均为甲烷 | |
| B. | 煤中含有苯、甲苯及多种化工原料,可通过煤的干馏获得 | |
| C. | 石油主要是各种烷烃、环烷烃、烯烃组成的混合物 | |
| D. | 乙烯和氯乙烯都可以通过聚合反应得到高分子材料 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Na2CO3固体 | B. | NaCl溶液 | C. | 浓H2SO4 | D. | KNO3溶液 |
查看答案和解析>>
科目: 来源: 题型:多选题
| A. | 未用标准液润洗碱式滴定管 | |
| B. | 滴定终点读数时,俯视滴定管的刻度 | |
| C. | 盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗 | |
| D. | 滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 元素周期表分为7个主族、7个副族、1个0族、1个VIII族,共18个纵行 | |
| B. | 己知As元素位于第四周期VA族,故NH3比 AsH3稳定 | |
| C. | 已知Sr元素位于第五周期IIA族,故Sr(OH)2碱性比Mg(OH)2弱 | |
| D. | 副族元素中没有非金属元素 |
查看答案和解析>>
科目: 来源: 题型:解答题
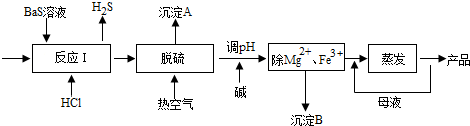
查看答案和解析>>
科目: 来源: 题型:解答题
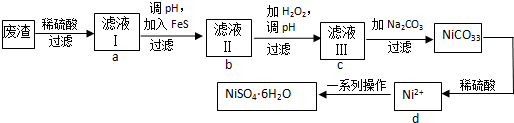
查看答案和解析>>
科目: 来源: 题型:填空题
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 气态氢化物稳定性:R>Q | |
| B. | 元素T的离子半径>元素R的离子半径 | |
| C. | 与w同主族的某元素形成的18电子的氢化物分子中既有极性键又有非极性键 | |
| D. | Q可形成多种含氧酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com