
科目: 来源: 题型:选择题
| A. | 标准状况下,1L庚烷所含有的分子数为$\frac{{N}_{A}}{2.4}$ | |
| B. | 1mol甲基(-CH3)所含电子数为9NA | |
| C. | 标准状况下,B2H6和C2H4的混合气体22.4L,所含的电子数约为16NA | |
| D. | 28g C3H6和C4H8的混合气体中所含C原子数为2NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | △H>0、△S>0 | B. | △H<0、△S<0 | C. | △H<0、△S>0 | D. | △H>0、△S<0 |
查看答案和解析>>
科目: 来源: 题型:选择题

| A. | 该反应为吸热反应 | |
| B. | 催化剂能降低正反应的活化能,但不能降低逆反应的活化能 | |
| C. | 催化剂能改变反应的历程 | |
| D. | 催化剂不能改变反应的焓变 |
查看答案和解析>>
科目: 来源: 题型:选择题
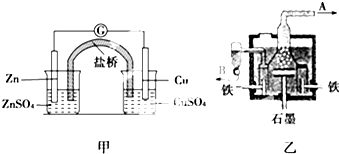
| A. | 甲装置中锌为负极,发生氧化反应,SO42-向铜极移动 | |
| B. | 乙装置中B是氯气出口,A是钠出口 | |
| C. | 乙装置中铁极为阳极,石墨为阴极 | |
| D. | 甲装置中的反应是自发反应,有化学能转化为电能;乙装置中的反应是非自发反应,有电能转化为化学能 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 从C(s,石墨)═C(s,金刚石)△H=+1.9 kJ•mol-1,可知石墨比金刚石更稳定 | |
| B. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多 | |
| C. | 由H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,可知含1 mol CH3COOH的溶液与含1 mol NaOH的溶液充分混合反应,放出的热量等于57.3 kJ | |
| D. | 2g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(l)△H=+571.6 kJ•mol-1 |
查看答案和解析>>
科目: 来源: 题型:填空题
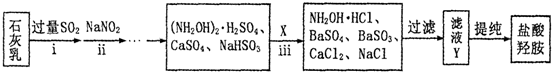
 ;
;
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 原子晶体 | B. | 离子晶体 | C. | 分子晶体 | D. | 金属晶体 |
查看答案和解析>>
科目: 来源: 题型:选择题
 纳米材料的表面粒子数占粒子总数的比例很大,这是它有许多特殊性质的原因.假设某硼镁化合物的结构如图所示(六个硼原子位于棱柱内),则这种纳米颗粒的化学式( )
纳米材料的表面粒子数占粒子总数的比例很大,这是它有许多特殊性质的原因.假设某硼镁化合物的结构如图所示(六个硼原子位于棱柱内),则这种纳米颗粒的化学式( )| A. | Mg3B6 | B. | Mg14B6 | C. | MgB2 | D. | Mg5B12 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com