
科目: 来源: 题型:选择题
| A. | 用10ml的量筒准确量取8.80ml的稀硫酸 | |
| B. | 用NaOH溶液作标准液滴定未知浓度的醋酸,选择甲基橙做指示剂 | |
| C. | 测定中和反应的热反应,将碱缓慢倒入酸中,所测温度值不变 | |
| D. | 氯水或硝酸银溶液存放在配有磨口塞的棕色玻璃瓶中 |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 用氨水吸收过量的SO2:2NH3•H2O+SO2=2NH4++SO32-+H2O | |
| B. | Ca(HCO3)2 溶液中加入少量澄清石灰水:HCO3-+Ca2++OH-=CaCO3↓+H2O | |
| C. | FeI2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| D. | NaClO溶液和FeCl2溶液混合:2ClO-+Fe2++2H2O=Fe(OH)2↓+2HClO |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 0.2mol•L-1醋酸溶液和0.2mol•L-1醋酸钠溶液等体积混合:C(CH3COOH)+C(H+)-C(OH-)=0.1mol•L-1 | |
| B. | pH相等的①(NH4)2SO4②NH4HSO4③NH4Cl溶液:c(NH4+)大小顺序为:①>②>③ | |
| C. | 0.1mol•L-1Na2CO3溶液中c(Na+)+c (H+)=C (CO32-)+c(HCO3-)+c(OH-) | |
| D. | 0.1mol•L-1的NaHB溶液,其中PH=4:c(HB-)>c(H+)>c(H2B)>c(B2-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 标况下,2.24L Cl2完全溶于水转移电子数为0.1NA | |
| B. | 1L 0.1mol•L-1 NaClO溶液中,ClO-的数目为NA | |
| C. | 2gNO2和44gN2O4的混合气体所含原子数为3NA | |
| D. | 18gD2O所含的电子数为10NA |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 日常生活中无水乙醇常用于杀菌消毒 | |
| B. | 棉、麻、丝、毛及合成纤维完全燃烧都只生成CO2和H2O | |
| C. | 加热能杀死流感病毒式因为病毒的蛋白质受热变性 | |
| D. | 人造纤维、合成纤维和光导纤维都是有机高分子化合物 |
查看答案和解析>>
科目: 来源: 题型:解答题
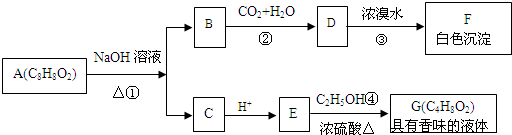
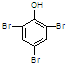 ;
;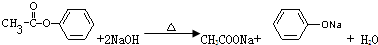 ;
;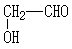 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.
元素周期表中第四周期元素由于受3d电子的影响,性质的递变规律与短周期元素略有不同.查看答案和解析>>
科目: 来源: 题型:解答题
 原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,B的单质分子中有三对共用电子,C最外层电子数是次外层电子数的3倍,A、D同主族,E原子电子数比C原子电子数多5个,请回答下列问题:
原子序数依次增大的A、B、C、D、E五种短周期元素,A是原子半径最小的元素,B的单质分子中有三对共用电子,C最外层电子数是次外层电子数的3倍,A、D同主族,E原子电子数比C原子电子数多5个,请回答下列问题: ,以W溶液作为电解质溶液,E棒与铁棒分别作为电极构成原电池,则负极的电极反应式Al-3e-+4OH-=AlO2-+2H2O;
,以W溶液作为电解质溶液,E棒与铁棒分别作为电极构成原电池,则负极的电极反应式Al-3e-+4OH-=AlO2-+2H2O;查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 将LiCoO2改写成为氧化物的形式为Li2O•Co2O3 | |
| B. | 该电池的电解液必须使用有机溶剂主要是由于有机溶剂有良好的导电性 | |
| C. | Li是3号元素,是最轻的金属之一,这类电池质能比高 | |
| D. | 在电池充放电时,Li+在两个电极之间往返嵌入和脱嵌.该电池的充放电反应方程式为:LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6 |
查看答案和解析>>
科目: 来源: 题型:选择题
| 元素代号 | L | M | X | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +2 | -2 |
| A. | R的氧化物对应的水化物可能具有两性 | |
| B. | X单质可在氧气中燃烧生成XO3 | |
| C. | 离子半径大小:r (M3+)>r (T2-) | |
| D. | L2+和X2-的核外电子数相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com