
科目: 来源: 题型:解答题
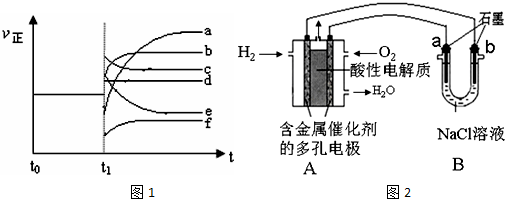
| 容器编号 | c(H2O)/mol•L-1 | c(CO)/mol•L-1 | c(H2)/mol•L-1 | ν正、ν逆比较 |
| I | 0.06 | 0.60 | 0.10 | ν正=ν逆 |
| Ⅱ | 0.12 | 0.20 | ①0.6 | ν正=ν逆 |
| Ⅲ | 0.10 | 0.20 | 0.40 | ②ν正>ν逆 |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:解答题
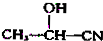 $→_{H_{2}O}^{HCl}$
$→_{H_{2}O}^{HCl}$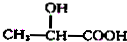
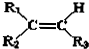 $→_{②Zn/H_{2}O}^{①O}$
$→_{②Zn/H_{2}O}^{①O}$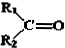 +
+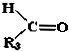
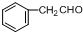 .现有如下转化关系:
.现有如下转化关系: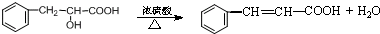 ;反应类型为消去反应;
;反应类型为消去反应;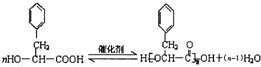 ;
;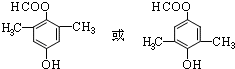 .
.查看答案和解析>>
科目: 来源: 题型:解答题
 ;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.
;由A、D两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X中所含化学键类型极性键、非极性键;向X中加入酸性KMnO4溶液,写出二者恰好反应的离子方程式5H2O2+2MnO4-+6H+=5O2↑+2Mn2++8H2O; 化合物E2 D2与化合物E2H的水溶液按物质的量比1:1反应生成单质H的化学方程式为Na2O2+2H2O+Na2S=S↓+4NaOH.查看答案和解析>>
科目: 来源: 题型:选择题
| A | B | C | D |
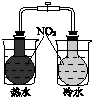 | 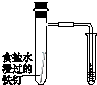 | 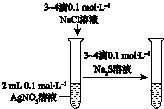 | 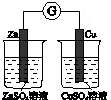 |
| 验证温度对平 衡移动的影响 | 验证铁 发生析氢腐蚀 | 验证AgCl 溶解度大于Ag2S | 验证化学能 转化为电能 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 用Ag作电极电解硝酸银溶液:4Ag++2H2O $\frac{\underline{\;通电\;}}{\;}$ 4Ag+O2↑+4H+ | |
| D. | 向AgCl悬浊液中加入饱和NaI溶液反应的离子方程式:AgCl+I-═AgI+Cl- |
查看答案和解析>>
科目: 来源: 题型:解答题
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 该溶液的pH小于7 | B. | c(CH3COOH)+c(CH3COO-)=0.20 mol•L-1 | ||
| C. | c(CH3COO-)+c(OH-)=0.10 mol•L-1 | D. | c(CH3COOH)<c(CH3COO-) |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 漂白粉溶液在空气中长时间放置:ClO-+CO2+H2O=HClO+HCO3- | |
| B. | FeBr2溶液中通入少量Cl2:2Fe2++Cl2=2Fe3++2Cl- | |
| C. | AgNO3溶液中加入过量稀氨水:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| D. | SO2使氯水褪色:SO2+Cl2+2H2O=SO42-+2Cl-+4H+ |
查看答案和解析>>
科目: 来源: 题型:选择题
| A. | 根据是否具有丁达尔现象把分散系分为溶液、胶体、浊液 | |
| B. | 根据在水溶液里或熔化状态下是否导电把物质分为电解质、非电解质 | |
| C. | 凡是含有碳元素的物质为有机物,不含碳元素的物质为无机物 | |
| D. | 根据密度大小把金属分为轻金属和重金属 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com